возможно ли вырастить мозг
Как ученые смогли вырастить мини-мозг с рабочими глазами?
Выращивание органов — это перспективная технология, которая позволяет людям не ждать донорских частей тела для пересадки в случае серьезных болезней. Благодаря ей, медики могут вырастить искусственный мочевой пузырь или другой несложный орган, пересадить его в организм человека и спасти ему жизнь. Выращенные искусственным образом органы принято называть органоидами. Помимо получения донорских органов, ученые используют эту технологию для изучения разных болезней человека и изобретения методов их лечения. Наука постоянно развивается и недавно немецким ученым в очередной раз удалось пробиться вперед и вырастить в лаборатории небольшой головной мозг. Результат оказался настолько хорошим, что впоследствии на сложном органе начали развиваться настоящие глаза. Звучит как что-то сложное и это действительно так. Однако, весь процесс выращивания головного мозга можно объяснить простыми словами.
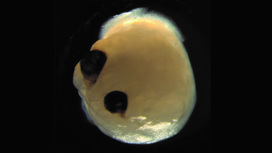
Мини-мозг, который удалось вырастить немецким ученым
Важно! Не надо путать органоиды с органеллами. Органоиды — это искусственно выращенные органы, а органеллы — разного рода вещества, которые содержатся внутри клеток живых организмов.
Как выращивают искусственные органы?
Если говорить очень кратко и без сложных терминов, основой всех органоидов являются стволовые клетки. Они обладают удивительным свойством превращаться в клетки тканей самых разных органов — главное, чтобы они были помещены в соответствующую среду. Например, в случае с головным мозгом, ученым было необходимо взять несколько стволовых клеток у добровольцев и поместить их в условия, в которых обычно развивается человеческий мозг. Речь идет об окружении, богатой определенными питательными веществами и комфортных для размножения клеток температуры, влажности и других свойств.
Само собой разумеется, выращивание органов происходит в стерильных помещениях
Мозг выращенный в лаборатории
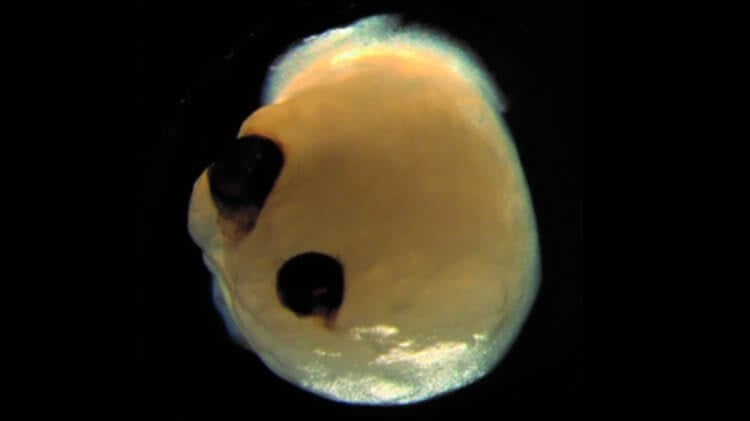
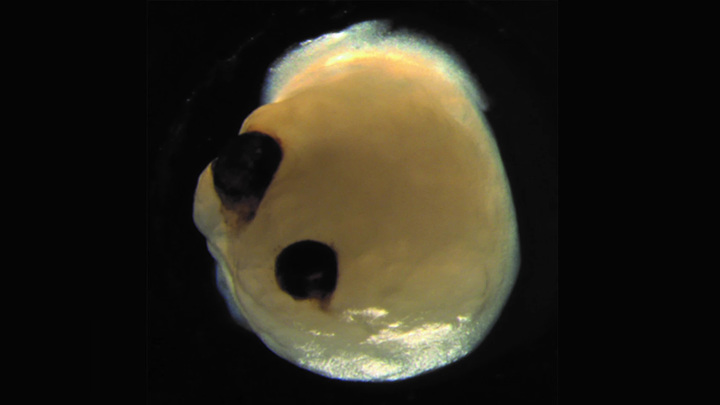
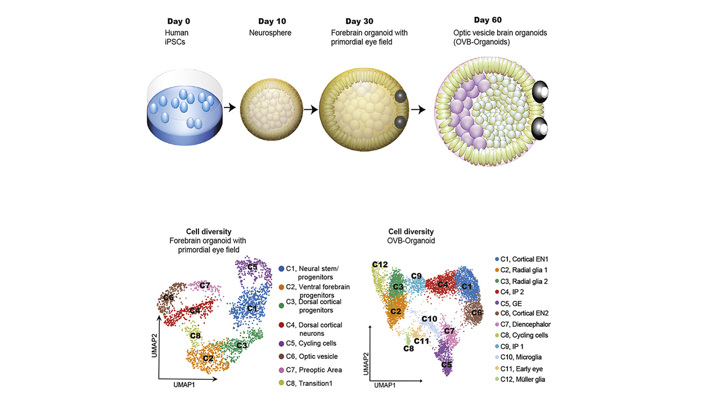
О том, как немецкие ученые вырастили небольшой мозг с глазами, было рассказано в научном журнале Cell Stem Cell. На первой стадии научной работы группа ученых взяла образцы клеток кожи доноров и при помощи генной инженерии превратила их в стволовые клетки. В данном случае добровольцами выступили четыре человека, из клеток которых в конечном итоге выросли 314 ограноидов головного мозга.
Разные стадии развития органоида
Ученые поместили их в благоприятную для развития среду и наблюдали за тем, как в 72% мини-мозгов начали развиваться зрительные пузырьки. Так называются мешочки на поверхности эмбрионов, из которых впоследствии вырастают полноценные глаза. Ученые заметили образование структур на 30 день жизни органоида и продолжили наблдение вплоть до 60 дня. Было отмечено, что глаза развивались одновременно, как на самом настоящем эмбрионе. Зрительные пузырьки имели при себе разные типы клеток сетчатки, которые могли улавливать свет и посылать сигналы в мозг. Можно сказать, что пузырьки имели все свойства настоящих глаз.
Этические вопросы медицины
По словам одного из авторов научной работы Джея Гопалакришнана (Jay Gopalakrishnan), созданный органоид мозга с глазами может помочь изучить нарушения зрения, которые возникают у детей в утробе матери. После изучения можно будет разработать новые методы лечения проблем со зрением и испытать их на органеллах, а не на живых людях. Только вот есть одна этическая проблема — возможно, выращенный в лаборатории мозг уже обладает сознанием. Если это действительно так, то ученые могут сами того не подозревая быть причиной страдания живого создания. Выращенный немецкими учеными мозг очень примитивен и вероятность наличия у него сознания очень мала. Но если в будущем они создадут что-то более сложное по своей структуре, могут возникнуть большие сложности.
Ссылки на интересные статьи, смешные мемы и много другой интересной информации можно найти на нашем телеграм-канале. Подпишитесь!
Напоследок стоит отметить, что сегодня ученые умеют создавать даже искусственные сердца. Только вот они изготавливаются не из стволовых клеток, а по своей сути являются электронными устройствами. Недавно одно из самых навороченных искусственных сердец было разработано французской компанией Carmat. Новинка оснащена биологическими клапанами, благодаря чему организм любого человека воспримет новый орган как что-то родное. Устройство способно обеспечивать человеку жизнь на протяжении 180 дней, чего иногда вполне хватает для того, чтобы дождаться настоящего донорского органа. Главным минусом искусственного сердца Carmat является то, что человеку нужно всегда носить с собой 4-килограммовый ящик. Подробнее обо всем этом я рассказывал тут.
Нейрогенез: вырасти себе мозговые клетки!
Гиппокамп — одна из наиболее поразительных частей нашего мозга. Он важен не только для обучаемости, запоминания, эмоций, но и для образования новых нейронов. Этот процесс и называют нейрогенезом.

Ученые из института Каролины высчитали, что в этом отделе мозга ежедневно производится 700 новых нейроклеток. И к 50 годам у взрослого человека все данные от рождения нейроны целиком обновляются вновь созданными!
Почему они так важны? Потому что от них зависят продуктивность процесса обучения и запоминания. Если не дать мозгу создавать новые клетки в гиппокампе, то отдельно взятые свойства памяти блокируются. Особенно больно это «ударит» по распознаванию пространства — например, ориентации на местности.
Можно ли осуществлять управление нейрогенезом? Однозначно — да. Но важно знать, что стимулирует процесс, а что ему мешает.
Существует гипотеза, что действия, заставляющие кровь приливать к головному мозгу, положительно влияют на нейрогенез. Поэтому старайтесь вести в привычку занятия аэробными упражнениями (150 минут в неделю) — в спортзале или на улице. Подойдут также командные виды спорта (социальное взаимодействие и приятный эмоциональный фон тоже полезны для успешного нейрогенеза).
А вредная еда — это, в первую очередь, все жирное (насыщенные жиры) и алкоголь, содержащий этанол. Впрочем, имеются и встречные исследования о том, что резвератрол, входящий в химический состав красного вина, как раз помогает повысить выживаемость новых нейронов.
… Нейробиологам еще предстоит выяснить, каковы функции последних и как мы можем еще активнее улучшать нейрогенез. А нам всем остается почувствовать повышенную ответственность за этот важнейший процесс. И, конечно, заниматься саморазвитием и развитием скрытых резервов своего мозга.
Как это сделать, вы узнаете на интерактивной онлайн-лекции от экспертов Викиум — специалистов по нейропсихологии. Они не только поведают вам о новейших достижениях этой науки на благо человечества, но и проведут тестирование когнитивных функций мозга каждого (!) участника лекции.
В итоге вы получите персональный набор рекомендаций, упражнений и методик, которые помогут вашему мозгу пробудиться и «раскрутиться» на полную мощность. Удивительные изменения к лучшему во всех жизненных сферах не заставят себя ждать: вы на порядок улучшите память, личную продуктивность, эффективность обучения, быстроту мышления и многие другие когнитивные факторы!
В лаборатории вырастили мини-мозг с глазами
Около 72 процентов органоидов мозга образовали зрительные пузырьки – выступающие из переднего мозга эмбриона мешочки, из которых впоследствии развиваются глаза.
Фото Cell.com.
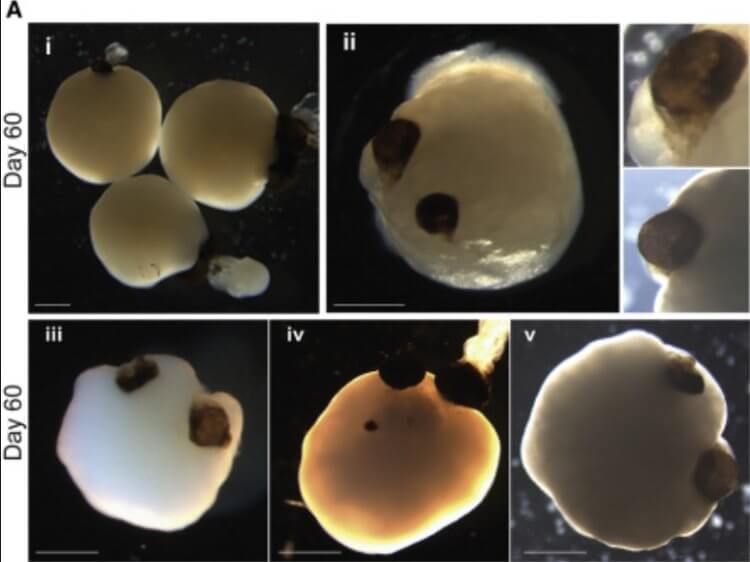
Примерно на 30-й день жизни органоиды мозга конструируют зрительные пузырьки, которые постепенно развиваются в видимые структуры в течение следующих 60 дней.
Иллюстрация Cell Stem Cell.
Команда ученых из нескольких немецких университетов вырастила органоид мозга – мини-версию мозга. Органоид затем сам «сконструировал» зрительные пузырьки, из которых развились клетки тканей глаза. Статью об этом исследователи опубликовали в научном журнале Cell Stem Cell.
Напомним, органоидом называют миниатюризированный и упрощенный вариант органа, выращенный в пробирке в трехмерном виде. Органоиды выращивают из стволовых клеток, которые обладают способностью превращаться в клетки разных тканей и органов.
Для создания органоидов мозга исследователи использовали индуцированные плюрипотентные стволовые клетки. Чтобы их получить, клетки кожи взрослых доноров с помощью «перепрограммирования» генов превращают в стволовые плюрипотентные – то есть те, из которых можно вырастить клетки любого органа.
К примеру, для выращивания мини-мозга плюрипотентные стволовые клетки помещают в культуру, которая имитирует среду развивающегося мозга. Конечным результатом является трехмерная модель мозга размером с горошину, которую можно использовать для изучения развития мозга, его болезней или воздействия лекарств на него.
Органоиды мозга немецкие исследователи вырастили из индуцированных плюрипотентных стволовых клеток от четырех доноров. Таким образом удалось получить 314 органоидов мозга.
Около 72 процентов органоидов мозга образовали зрительные пузырьки – выступающие из переднего мозга эмбриона мешочки, из которых впоследствии развиваются глаза. Эти структуры начали появляться через 30 дней жизни мини-мозга и созревали в течение 60 дней. Они росли симметрично, парой, как в настоящем мозге эмбриона.
Но самое главное, эти зрительные пузырьки имели функции настоящего глаза. Они содержали разнообразные типы клеток сетчатки, которые формировали нейронные сети, реагировали на свет и посылали эти сигналы в мозг. В зрительных пузырьках органоида мозга формировалась также ткань хрусталика и роговицы.
Эти глазоподобные структуры в органоидах мозга исследователи назвали в своей научной статье органоидами глаза.
«Наша работа подчеркивает замечательную способность органоидов мозга генерировать примитивные сенсорные структуры, которые являются светочувствительными и содержат типы клеток, подобные тем, которые находятся в организме, – говорит Джей Гопалакришнан (Jay Gopalakrishnan) из Университета Дюссельдорфа, ведущий автор исследования. – Эти органоиды могут помочь изучить взаимодействие мозга и глаза во время эмбрионального развития, моделировать врожденные нарушения устройства сетчатки и генерировать специфические для пациента типы клеток сетчатки для персонализированного тестирования лекарств и трансплантационной терапии».
Правда, на пути реализации это прекрасного сценария стоит важное препятствие. Исследования органоидов мозга имеют свои этические ограничения. Пока выращенные в пробирке образцы мини-мозга остаются очень примитивными, считается, что они не обладают каким бы то ни было сознанием. Но если ученые создадут более совершенную структуру, близкую к настоящему человеческому мозгу, вполне возможно, что органоиды будут обладать какими-то формами сознания.
Так, предыдущие исследования уже обнаруживали мозговые волны внутри двухмесячных органоидов, и они оказались примерно эквивалентными таковым у недоношенных детей.
Сенсорная информация, такая как зрение, может быть ключевым компонентом сознания мозга, выращенного в пробирке. Это проблема, которая выходит за пределы просто научного знания.
Добавим, что ранее мы писали, как из стволовых клеток ученые впервые получили мышиный эмбрион с бьющимся сердцем и как здоровые стволовые клетки удалось вырастить «на бумаге». А еще мы рассказывали о том, как стволовые клетки вернули людям подвижность.
Больше интересных новостей науки и медицины вы найдёте в разделе «Наука» и «Медицина» на медиаплатформе «Смотрим».
Зачем ученые выращивают в пробирках мозги и смогут ли они научить их думать?
Искусственные органы сегодня не фантастика, а реальность: «в пробирках» уже выращивают сосуды и кожу, активно разрабатываются технологии производства новых легких и сердца. Но один из главных вызовов для ученых — хотя бы отчасти воссоздать сложнейшую структуру нашего мозга, чтобы больше узнать о том, как он работает. Сделать первые шаги к этому позволяют мини-мозги — органоиды, выращенные из стволовых клеток. Почитайте о том, как их создают, как они помогают исследовать процессы, связанные со старением организма и развитием болезни Альцгеймера, и могут ли миниатюрные фрагменты тканей научиться мыслить так же, как мы.
Что такое мини-мозг?
Говоря о головном мозге, многие представляют привычную картинку — крупный орган со множеством извилин. Иногда СМИ иллюстрируют так и статьи об органоидах, поэтому, когда речь идет об искусственных тканях, легко вообразить себе нечто вроде гигантских светящихся мозгов из «Футурамы». На деле органоиды мозга выглядят куда скромнее. Кусочки вещества в лабораторных чашках Петри обычно не превышают размеров горошины или ластика на конце карандаша, а порой для экспериментов достаточно фрагмента с булавочную головку.
Для чего же нужны миниатюрные органоиды? Прежде всего, это отличный способ исследовать человеческий мозг. Несмотря на развитие технологий, изучать его по-прежнему непросто — настолько хорошо развиты структуры, защищающие орган от внешних воздействий. Поэтому науке приходится искать обходные пути: изучать активность мозга с помощью нейровизуализации (например, магнитно-резонансной томографии) или проводить эксперименты с лабораторными животными. Но эти методы не идеальны: для некоторых исследований у томографии не хватает точности, а мозг мышей и обезьян всё же сильно отличается от нашего.
Органоиды, созданные в лабораториях, позволяют работать с тканями, похожими на человеческий мозг, напрямую.
Таким образом, можно «вживую» увидеть, как на них воздействуют возбудители различных болезней (скажем, вирус Зика) или протестировать новые лекарства перед тем, как проводить испытания с участием людей. Это далеко не все сферы, где могут пригодиться мини-мозги, — а ведь технологии не исполнилось и десяти лет!
Волшебные коктейли: как вырастить органоид мозга?
Чтобы создать такой органоид, нужно прежде всего обзавестись строительным материалом — клетками, подобными нейронам и глиальным клеткам человеческого мозга. Как и множество сегодняшних технологий создания искусственных тканей, эта методика не обходится без стволовых клеток (СК). Почему именно они? Дело в том, что большая часть клеток человеческого тела способна давать начало только клеткам того же типа, что и они сами: «потомки» обладают теми же размерами, формой и функциями, что и «родители». Стволовые клетки, напротив, династий не создают: представители новых поколений могут развиваться по-разному и со временем входить в состав разных тканей организма.
Особенно перспективны плюрипотентные СК — те, что способны дифференцироваться («превращаться») почти во все типы клеток, присутствующих во взрослом организме. Где искать такие клетки? Например, ими обладают эмбрионы, из этих СК постепенно развиваются ткани растущего зародыша. Часть СК для исследований получают из бластоцист (эмбрионов на одной из самых ранних стадий развития), оставшихся невостребованными при процедурах экстракорпорального оплодотворения. Поскольку для ЭКО нужны не все полученные в лаборатории зародыши, доноры могут разрешить ученым использовать «лишние» эмбрионы для научной работы.
C использованием зародышей связано немало этических проблем, поэтому ученые искали способ создать плюрипотентные клетки искусственно. В 2006 году эту задачу решили японские исследователи под руководством Синъи Яманаки (спустя несколько лет он получил за открытие Нобелевскую премию). Они выяснили, что можно превратить соматические («обычные», не стволовые) клетки взрослого человека — например, клетки кожи — в плюрипотентные СК. Для этого в их геном ввели четыре транскрипционных фактора (ТФ) — это белки, которые влияют на активность определенных генов. Нужную комбинацию ТФ искали долго, и японцы первыми создали работающий рецепт. Эти гены до сих пор называют «волшебным коктейлем Яманаки».
Но получить необходимый материал — это лишь полдела. Дальше начинается настоящее строительство: все клетки должны занять свои места в объемной структуре. Впервые добиться этого смогла команда британских и австрийских биологов под руководством Мэдлин Ланкастер. Ученые сформировали из клеток небольшие объемные скопления, а затем поместили их в капли специального белкового желе. Несколько недель эти капли держали в биореакторе, аккуратно перемешивая их в теплом насыщенном «бульоне», чтобы клетки получали достаточно кислорода и питательных веществ. Спустя месяц небольшие комочки ткани приобрели структуру, характерную для конкретных областей человеческого мозга.
Ученым удалось обеспечить образцам три месяца «жизни» — за это время модели прошли те же этапы формирования, что и развивающийся мозг.
Такой принцип создания органоидов используют и сегодня, но ученые по всему миру то и дело предлагают новые детали, улучшающие технологию. Например, группа Паолы Арлотты из Гарварда нашла способ поддерживать развитие тканей в биореакторе в течение полугода. Чем больше времени проходит, тем больше необходимых структур успевают развить мини-мозги — а значит, модели становятся всё более похожими друг на друга и лучше подходят для исследований.
Арлотта говорит: «Раньше каждый органоид был „уникальной снежинкой“, в которой специфический набор типов клеток располагался таким образом, что предугадать это изначально было невозможно. Мы решили эту проблему».
Технология получения мини-мозгов очень молода, и ученым предстоит решить еще немало задач. Одна из главных сложностей в том, что жизнь сегодняшних органоидов коротка: спустя несколько месяцев они перестают развиваться, а иногда и «задыхаются» от недостатка кислорода. Чтобы увеличить срок существования моделей, биологи планируют обеспечить их аналогом кровеносных сосудов — это позволит лучше снабжать органоиды кислородом. Первые подобные технологии уже появились, но им предстоит долгий путь развития.
Болезни, космос, неандертальцы: как проводят эксперименты с органоидами
Одна из перспективных сфер применения новой технологии — исследования нейродегенеративных заболеваний, в том числе болезни Альцгеймера. Неоднократно случалось, что новые методики, отлично работающие на лабораторных мышах со схожими нарушениями работы мозга, оказывались бесполезны для людей. Мини-мозги здесь незаменимы — особенно если учесть, что они помогают моделировать ранние стадии болезни. Изучая органоиды, ученые могут наблюдать, как в тканях накапливаются бета-амилоиды и формируются характерные скопления этих веществ.
Это исследование важно не только для тех, кто мечтает когда-нибудь стать космонавтом.
Изменения, вызванные невесомостью, во многом схожи с признаками старения организма: например, стенки сосудов становятся жестче и толще.
Условия МКС заставят органоиды стареть быстрее, чем на Земле. Значит, ученым не придется беспокоиться о том, как продлить срок жизни мини-мозгов, чтобы увидеть, как они меняются со временем: важные процессы можно будет наблюдать в «ускоренной перемотке». Один из руководителей проекта, Алиссон Муотри, надеется, что со временем органоиды получится выращивать прямо на космических станциях, чтобы не терять драгоценное время.
Биологи считают, что делать выводы о мышлении неандертальцев на этом основании не стоит — слишком мало нам известно о «несостоявшемся человечестве». Зато эта работа может стать основой для новых исследований. Результатами уже заинтересовался шведский биолог Сванте Паабо: по его словам, неандероиды можно сравнивать и с уже привычными органоидами, и с теми, что созданы на основе клеток шимпанзе.
Думай, как я: может ли мини-мозг мыслить?
Исследования органоидов приносят немало интересных результатов, но и вопросов вызывают не меньше. В последнее время многие из этих вопросов этические. Особенно часто этику стали обсуждать после появления новостей о том, что тому же Алиссону Муотри удалось довести срок «жизни» модели до 10 месяцев. Полученный органоид по характеру электрической активности напоминал мозг недоношенного ребенка.
Несколько исследователей высказали свои опасения: не приближаются ли Муотри с коллегами к той грани, за которой эксперимент становится неэтичным? Иными словами, можем ли мы быть уверены в том, что мини-мозг не страдает при опытах? Самые решительные из скептиков даже призвали фонды не финансировать работы, связанные с перспективой вживления «человеческих» мозговых органоидов в лабораторных животных.
Значит ли это, что со временем мини-мозги обретут собственный разум? Большинство ученых считают, что это не так — по крайней мере, в ближайшее время.
Мэдлин Ланкастер отмечает, что органоиды ничтожно малы по сравнению с мозгом человека, к тому же они еще долго не разовьют того разнообразия структур, что есть у нас.
Исследовательница сравнивает такой органоид с самолетом, который разобрали, а затем вновь скрепили его детали в случайном порядке. Рассматривать и изучать его можно, но такой самолет уже никогда не взлетит.
Подобные вопросы вряд ли заставят ученых отказаться от экспериментов с мини-мозгами. Скорее, научное сообщество выработает единый свод этических правил, которые будут регулировать эти исследования. Создать такие документы уже призвали специалисты в области нейронаук из Пенсильванского университета.
Пожалуй, самое интересное в органоидах мозга — то, что главные научные результаты, которые способна принести эта технология, еще впереди. Мы своими глазами видим, как зарождается новое научное течение, и тем увлекательнее следить, к чему это приведет.
Лилипут мысли Как и зачем биологи вырастили «в пробирке» миниатюрный человеческий мозг
Австрийские ученые впервые вырастили из стволовых клеток миниатюрное подобие человеческого мозга. Строго говоря, то, что у них получилось, полноценным мозгом назвать нельзя. Однако этот «церебральный органоид», как прозвали его авторы, обладает многими свойствами своего прототипа: в нем есть разные отделы, его нейроны взаимодействуют между собой и формируют функциональные группы, в процессе его роста в биореакторе происходит характерная для нормального развития миграция нейронов. Как этого удалось достичь и зачем ученым вообще понадобилось выращивать мозг в пробирке, разбиралась «Лента.ру».
Важность исследований по созданию искусственных органов очевидна. Искусственные органы при трансплантации имеют значительные преимущества над обычными донорскими. Во-первых, для их создания можно использовать собственный клеточный материал пациента, что позволяет избежать отторжения. Во-вторых, искусственные органы для каждого конкретного человека можно выращивать сразу, не дожидаясь появления подходящего донора.
За последние несколько лет эти исследования развились в целую область, в которой даже обозначились два направления. Одни ученые для создания искусственных органов используют технику децеллюляризации, при которой донорские органы очищаются от клеток, а оставшийся бесклеточный матрикс заселяется новыми, полученными из разрушенных тканей или из стволовых клеток реципиента. Другие исследователи пытаются использовать стволовые клетки сами по себе и создавать искусственные органы буквально «с нуля».
Стволовыми называют клетки разных типов, которые объединены тем, что могут дифференцироваться во множество различных зрелых клеток организма. Из таких клеток состоит эмбрион на ранней стадии развития, но со временем их доля в организме падает. Впрочем, уже сегодня ученые умеют получать стволовые клетки из дифференцированных зрелых клеток организма, активируя в них определенные гены раннего развития. Делается это либо при помощи введения специальных генетических конструкций, либо, как было недавно показано, даже без них — с помощью химической активации. Такие искусственно полученные стволовые клетки называют индуцированными плюрипотентными клетками (iPS). Как и обычные эмбриональные стволовые клетки, они могут превращаться практически в любую клетку организма (то есть обладают свойством плюрипотентности) — для этого нужно только подобрать необходимые условия.
Используя как индуцированные, так и эмбриональные стволовые клетки, ученые сегодня создают все более сложные органы. В последние годы был создан искусственный мочевой пузырь, который даже удалось использовать для трансплантации, а также почка и печень. Кроме того, совсем недавно удалось вырастить искусственное сердце на основе бесклеточного матрикса мыши и индуцированных стволовых клеток человека.
Но можно ли с помощью стволовых клеток создать нервную ткань или даже мозг? С точки зрения нужд трансплантации это совершенно бессмысленно: вы же не хотите, чтобы вам пересадили чужой мозг? Однако же само по себе это безумно интересно. Насколько фантастически сложная структура нервной ткани определяется внутренними свойствами клеток? В какой степени мозг формируется самостоятельно — в отрыве от остального организма?
В 2008 году исследователи из Бельгии и Франции обнаружили, что эмбриональные стволовые клетки мыши, культивируемые in vitro, способны воспроизводить основные этапы развития коры головного мозга. Клетки, помещенные в чашку Петри со специальной средой, образовывали последовательные популяции нейронов, которые при развитии настоящего мозга слой за слоем формируют кору. Сначала формировались нейроэпителиальные клетки-предшественники — недифференцированные клетки, которые в процессе эмбрионального развития дают начало нервной системе. Затем из них образовывались астроциты (вспомогательные клетки, «обслуживающие» нейроны) и пирамидальные клетки (основные нейроны коры головного мозга). Пирамидальные клетки, в свою очередь, дифференцировались на различные подтипы корковых нейронов — причем порядок появления разных клеточных популяций соответствовал тому, что наблюдается во время развития настоящего мозга.
В том же году японские ученые показали, что полученные из эмбриональных стволовых клеток нейроны способны формировать концентрические слои, которые демонстрируют свойства различных слоев и регионов коры головного мозга. Порядок появления разных популяций нервных клеток здесь также соответствовал тому, что наблюдается in vivo: из нейроэпителиальных клеток формировались корковые нейроны, которые затем дифференцировались на различные подтипы.
В этом исследовании, в отличие от предыдущего, авторы дополнительно показали, как можно управлять ростом нейронов на чашках, добавляя те или иные факторы роста — соединения, при помощи которых различные клетки «разговаривают» друг с другом на химическом уровне. Оказалось, что путем добавления разных факторов роста можно произвольно менять региональную идентичность нейронов. Кроме того, исследователи смогли, замедляя или ускоряя дифференцировки клеток, избирательно получать различные слои коры.
Наконец, в последние два года было показано, что из эмбриональных стволовых клеток может формироваться полноценный глазной бокал (вырост мозга эмбриона, из которого образуется сетчатка глаза) и даже сетчатка с высокоорганизованной слоистой структурой.
box#1417674
В недавнем исследовании ученым наконец-то удалось создать из стволовых клеток не кусочек нервной ткани, а целую модель эмбрионального мозга. Ученые из Института молекулярных биотехнологий Австрийской академии наук (IMBA) показали, что полученные из стволовых клеток нейроны при помещении их в подходящие условия самоорганизуются и образуют подобие мозга человеческого эмбриона. Миниатюрному мозгу дали название «церебрального органоида» — потому что назвать его полноценным органом все-таки нельзя.
Для создания «мини-мозга» авторы использовали два типа стволовых клеток: и обычные эмбриональные, и индуцированные, полученные путем перепрограммирования фибробластов кожи. Клетки помещали в специальную среду, которая содержала необходимые питательные вещества и факторы роста. Из обоих типов клеток образовались сгустки нейроэпителиальной ткани. Их переносили в капли питательного синтетического геля, который заменял клеткам внеклеточный матрикс. Внеклеточный матрикс — это структура, состоящая в основном из белков и выполняющая «архитектурную» и транспортную роль во всех тканях и органах. Он определяет пространственные свойства ткани, участвует в миграции клеток, а также содержит иммобилизованные факторы роста, которые способны стимулировать клеточную дифференциацию «на местах». Именно такие структуры используются для создания искусственных органов на основе бесклеточного матрикса, о которых уже говорилось выше.
Затем капли геля c клетками переносили в биореактор — фактически просто вращающийся стерильный сосуд с управляемыми температурой и газовым составом. Там клетки в течение нескольких недель созревали и дифференцировались.
Развитие органоида, полученного из клеток здорового человека (сверху) и человека с микроцефалией (снизу).
Примерно через две недели в биореакторе появлялись первые «церебральные органоиды» диаметром от двух до четырех миллиметров. Внешне они не были похожи на маленький мозг, но их внутреннее устройство было удивительно схоже с натуральным прототипом. Во-первых, внутри органоидов появлялась полость, аналогичная мозговым желудочкам. Во-вторых, разные зоны органоида соответствовали разным отделам головного мозга: заднему, среднему и переднему, а «передний мозг» даже демонстрировал дальнейшую дифференциацию на доли — это удалось показать с помощью меченых флюоресцентными маркерами антител к специфическим антигенам разных типов клеток.
По мере развития органоида суммарное количество клеток, характерных для переднего отдела мозга, увеличивалось, а заднего — уменьшалось. Именно так и происходит при формировании мозга in vivo. Нервная ткань дифференцировалась на слои, соответствующие мозговой оболочке, гиппокампу, коре, сетчатке глаза и сосудистому сплетению (структуре, которая в желудочках мозга вырабатывает спинномозговую жидкость).
В слое, соответствующем коре головного мозга, происходила дальнейшая дифференциация. Клетки радиальной глии, образующиеся из исходных клеток, формировали вентрикулярную и прилежащую к ней субвентрикулярную зоны (обе они служат основным источником новых нейронов при развитии мозга). Субвентрикулярная зона, в свою очередь, разделялась на внешний и внутренний слои — дифференциация, характерная только для человека. В дальнейшем клетки радиальной глии тоже дифференцировались и даже мигрировали из внутренних областей органоида наружу, образуя внешние слои нейронов коры. Эти нейроны, созревая, формировали взаимодействующие между собой аксоны и демонстрировали кальциевые осцилляции, которые служат признаком активности — выросший из стволовых клеток «мини-мозг» начинал работать!
Авторам работы, однако, показалось недостаточным просто продемонстрировать то, насколько далеко может зайти развитие мозга без участия других частей организма. Чтобы показать, как получившийся органоид можно использовать в практических целях, ученые решили вырастить мини-мозг из клеток пациента с микроцефалией.
МРТ головного мозга новорожденного с микроцефалией (сверху) и здорового мозга (снизу).
Микроцефалия — это заболевание, которое характеризуется значительным уменьшением размера головного мозга и сопровождается умственной отсталостью. Чтобы понять ее этиологию, нужно иметь экспериментальную модель, но на мышах создать полноценную модель микроцефалии до сих пор не удавалось. Причина этого, во-первых, в том, что мозг у грызунов значительно меньше, чем у человека, и гораздо проще устроен: кора больших полушарий у них не имеет борозд и извилин. Во-вторых, мозг человека и мыши по-разному развивается — показано, что у грызунов нервные клетки-предшественники в вентрикулярной и субвентрикулярной зонах делятся и мигрируют далеко не так активно, как это происходит у человека. При этом они дают начало меньшему количеству слоев коры мозга.
Для того чтобы смоделировать развитие микроцефалии, исследователи вместо здоровых индуцированных стволовых клеток взяли клетки, полученные из фибробластов кожи человека с генетической формой микроцефалии. Органоиды, выращенные из таких клеток, оказались значительно меньше, чем контрольные. Участки собственно нервной ткани в таких органоидах были совсем небольшими по сравнению с контролем и содержали пониженное количество клеток радиальной глии. Число полностью дифференцированных нейронов, напротив, было повышенным. Это, как заключили авторы, указывает, что аномалия связана с ускоренным созреванием нервных клеток: клетки-предшественники созревают слишком рано и перестают давать новые нейроны, что приводит к остановке роста мозга. Становится понятно также, почему на мышах модель микроцефалии не работает: из-за более «пассивного» поведения клеток-предшественников уменьшение их популяции не дает такого сильного эффекта, как у человека.
box#1417663
Полученные результаты, конечно, не следует переоценивать: церебральный органоид довольно далек от полноценного мозга. Нетрудно понять почему: настоящий мозг у эмбриона развивается под влиянием не только внутренней программы, но и под воздействием сигналов от других частей организма, которых в биореакторе нет. Возможно, именно из-за этого аналоги разных отделов мозга в органоидах были расположены случайным образом и имели неправильную форму. Кора органоида, хотя и демонстрировала характерную слоистость, была устроена далеко не так сложно, как настоящая. И, конечно, не менее важно, что миниатюрный мозг не содержал кровеносных сосудов — из-за этого находящиеся в глубине клетки страдали от недостатка кислорода и питательных веществ. Максимальный размер полученных органоидов составлял всего 3-4 миллиметра — и даже при этом внутри них неизбежно появлялась зона мертвых клеток.
Теоретически проблема недостаточности кровоснабжения вполне решаема. Так, недавно японским исследователям удалось создать искусственную печень из индуцированных стволовых клеток человека. Из этих клеток ученые получили не только гепатоциты, но и клетки кровеносных сосудов и соединительной ткани — то есть все необходимые для печени элементы. В случае искусственных органов на основе бесклеточного матрикса, например, все сложнее. Дело в том, что при получении матрикса эпителиальные клетки, из которых состоят капилляры, удаляются вместе со всеми остальными клетками и практически не восстанавливаются при заселении органа новыми клетками. Как обойти эту проблему, ученые пока не придумали.
У методов создания искусственных органов из индуцированных стволовых клеток есть и другие подводные камни. Недавние исследования показали, что такие клетки чаще других перерождаются в опухолевые, и для использования искусственных органов на практике необходимо сначала понять, почему это происходит и как с этим бороться.
Однако, несмотря на все эти ограничения, исследовательская ценность выращенного in vitro мозга, безусловно, огромна. Уже сейчас церебральные органоиды можно использовать для изучения специфичных для человека процессов развития — в тех случаях, когда «мышиные» модели не могут предоставить необходимых сведений. Кроме того, такие органоиды могут быть полезны для тестирования лекарств.
Но будем честны, дело ведь не только в этом. Мозг в биореакторе — это еще и безумно красиво.