в красном костном мозге не созревают
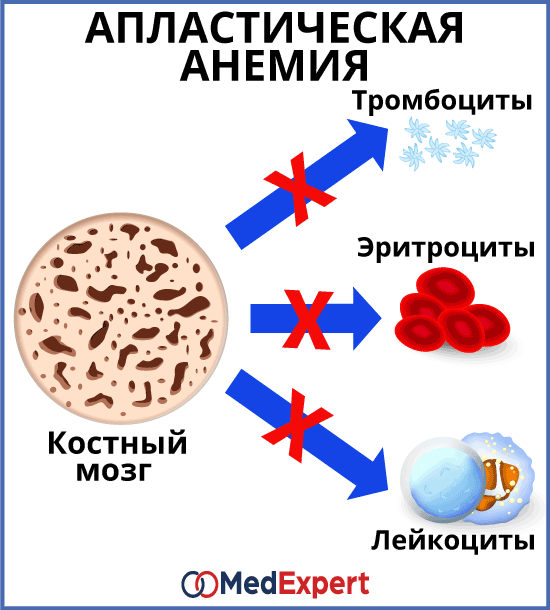
АПЛАСТИЧЕСКАЯ АНЕМИЯ (НЕДОСТАТОЧНОСТЬ КОСТНОГО МОЗГА)
Апластическая анемия – это заболевание, при котором костный мозг перестает производить клетки крови в достаточном количестве. Апластическая анемия сопровождается слабостью, повышает риск развития инфекционных заболеваний и неконтролируемых кровотечений.
Апластическая анемия – редкое, но очень тяжелое заболевание, которое может развиться в любом возрасте. Она может появиться внезапно или прогрессировать медленно в течение длительного времени, ухудшая состояние пациента.
Различают два вида заболевания:
СИМПТОМЫ АПЛАСТИЧЕСКОЙ АНЕМИИ
Каждый вид кровяных клеток выполняет свои функции:
Симптомы болезни зависят от того, каких кровяных клеток недостаточно, однако в некоторых случаях, может присутствовать дефицит всех трех видов клеток одновременно. Характерными симптомами являются:
При низком количестве эритроцитов:
При низком количестве лейкоцитов:
При низком количестве тромбоцитов:
Почему апластическую анемию можно спутать с миелодиспластическим синдромом?
Апластическую анемию можно спутать с заболеванием, которое называется миелодиспластическим синдромом. Миелодиспластический синдром – это группа заболеваний, при которых костный мозг вырабатывает новые кровяные клетки, но они деформированы или недоразвиты. При этом синдроме костный мозг иногда характеризуют как «гиперпластический», имея в виду, что в нем содержится много кровяных клеток. Но у некоторых пациентов с этим синдромом костный мозг почти пуст, поэтому заболевание может быть ошибочно диагностировано как апластическая анемия.
Взаимосвязь с другими редкими заболеваниями
У части больных с апластической анемией может наблюдаться такая редкая аномалия, как пароксизмальная ночная гемоглобинурия, при которой происходит слишком быстрое разрушение эритроцитов. Пароксизмальная ночная гемоглобинурия может привести к развитию апластической анемии, а также апластическая анемия может развиться в пароксизмальную ночную гемоглобинурию.
Анемия Фанкони – это редкое, наследственное заболевание, которое приводит к развитию апластической анемии. Дети, рожденные с болезнью Фанкони, обычно, отстают в развитии и могут иметь различные врожденные дефекты, такие как недоразвитость конечностей. Болезнь диагностируется при помощи лабораторных исследований крови.
ЛЕЧЕНИЕ АПЛАСТИЧЕСКОЙ АНЕМИИ
Лечение апластической анемии может заключаться в наблюдении и контроле состояния пациента при легкой степени тяжести заболевания, переливании крови и медикаментозном лечении в более тяжелых случаях, и в необходимости проведения трансплантации костного мозга в тяжелых случаях. Тяжелая форма апластической анемии, при которой количество кровяных клеток слишком низкое, представляет угрозу жизни и требует немедленной госпитализации и лечения.
Переливание крови
Лечение апластической анемии, обычно, включает переливание крови для того, чтобы контролировать кровотечения и уменьшить интенсивность симптомов. Переливание крови не может излечить от болезни, но будет способствовать уменьшению признаков и симптомов, восполняя кровяные клетки, которые костный мозг не в состоянии производить. Переливание крови может включать:
И хотя официально нет ограничений для количества переливания крови, все же многоразовые процедуры могут привести к осложнениям. Переливаемые эритроциты содержат железо, которое, накапливаясь в организме, может нанести ущерб жизненно важным органам при отсутствии необходимой терапии, способствующей его выведению из организма. Применение специальных препаратов поможет организму избавиться от избытка железа. Другое возможное осложнение может развиться со временем в связи с тем, что организм начнет вырабатывать антитела к переливаемым кровяным клеткам, что сделает лечение менее эффективным. Для снижения вероятности развития этого осложнения назначается иммуносупрессивная терапия.
Пересадка стволовых клеток
Пересадка стволовых клеток для восстановления здоровья костного мозга с помощью донорских стволовых клеток может быть единственным выбором для лечения тяжелой апластической анемии. Трансплантация стволовых клеток, иногда называемая пересадкой костного мозга, является предпочтительным методом лечения для пациентов молодого возраста, имеющих подходящего донора – чаще всего таковым является брат или сестра.
Если донор найден, то перед трансплантацией стволовых клеток пациент подвергается воздействию лучевой и химиотерапии, которые разрушают его собственный костный мозг, а вместе с ним злокачественные клетки, и освобождают место для нового костного мозга. Далее у донора производится забор стволовых клеток. Здоровые стволовые клетки вводят внутривенно, и по кровеносной системе они транспортируются в полости костей, где начинают производить новые клетки крови. Эта процедура требует длительной госпитализации. С целью предотвращения отторжения донорских стволовых клеток, после трансплантации назначаются специально действующие препараты.
Трансплантация стволовых клеток сопряжена с риском. Есть вероятность, что организм начнет отторгать трансплантат, что может привести к угрожающим жизни осложнениям. Кроме того, пересадка костного мозга показана не каждому пациенту, а также не всегда удается найти подходящего донора.
Иммуносупрессивная терапия
В случаях, когда пациенту невозможно провести пересадку костного мозга, или апластическая анемия является результатом аутоиммунных нарушений, для лечения заболевания назначают препараты, которые изменяют или подавляют иммунную систему (иммуносупрессанты).
К таким препаратам относятся циклоспорин (Gengraf, неорал, сандиммун) и антитимоцитарный глобулин (Тимоглобулин). Эти лекарственные везества подавляют деятельность иммунных клеток, которые повреждают костный мозг. Лечение помогает восстановить костный мозг и повысить содержание кровяных телец в крови. Циклоспорин и антитимоцитарный глобулин часто используются комбинировано.
В комплексе с этими препаратами часто назначаются кортикостероидные лекарства, такие как метилпреднизолон (медрол, солу-медрол).
Иммуносупрессоры могут быть очень эффективными для лечения апластической анемии. Отрицательным моментом является то, что эти препараты ослабляют иммунную систему. Кроме того, существует вероятность, что после отмены лекарств апластическая анемия может возвратиться.
Стимуляторы кроветворения в костном мозге
Некоторые препараты, включая колониестимулирующие факторы, такие как сарграмостим (лейкин), филграстим (нейпоген), пегфилграстим (нейласта) и эпоэтин альфа (эпоген, прокрит), могут стимулировать кроветворение в костном мозге. Препараты, стимулирующие кроветворение, могут применяться в комбинации с иммуносупрессорами.
Антибактериальное и противовирусное лечение
Апластическая анемия ослабляет иммунную систему в связи с тем, что в крови снижен уровень лейкоцитов, которые защищают организм от инфекций. Это делает больного восприимчивым к различным инфекционным заболеваниям.
При первых признаках инфекционного заболевания, таких как повышенная температура, жар, ломота во всем теле необходимо обратиться к врачу. Развитие инфекционного заболевания может быть опасным для жизни больного с апластической анемией. Для лечения и профилактики инфекционных заболеваний назначают антибактериальные и противовирусные препараты.
МЕТОДЫ ДИАГНОСТИКИ АПЛАСТИЧЕСКОЙ АНЕМИИ
Для диагностики апластической анемии рекомендуются следующие методы:
Тромбоцитопения (пурпура)
Тромбоцитопения у детей и взрослых может быть самостоятельной болезнью (первичная форма) или симптомом патологий других систем и органов (вторичная тромбоцитопения). Наиболее часто проблема встречается у дошкольников и людей старше 40 лет.
По критерию продолжительности протекания в организме заболевание классифицируют на:
Причины
Тромбоциты представляют собой форменные элементы крови, безъядерные плоские пластинки размером от 1 до 2 мкм. Они образуются из мегакариоцитов (клеток-предшественников) в красном костном мозге.
Мегакариоциты — относительно большие клетки. Они имеют длинные отростки и почти полностью заполнены цитоплазмой. В ходе созревания крошечные фрагменты их отростков отделаются и поступают в кровоток. Это и есть тромбоциты. Согласно научным данным, из одной клетки-донора может образоваться от 2000 до 8000 тромбоцитов.
За развитие и рост мегакариоцитов отвечает тромбопоэтин — белковый гормон, образующийся в почках, печени и мышцах. С кровотоком он переносится в красный костный мозг, где обеспечивает образование мегакариоцитов и тромбоцитов. Чем больше становится тромбоцитов, тем сильнее тормозится процесс образования тромбопоэтина. Это позволяет поддерживать количество форменных элементов крови на одном уровне.
Если на любом из перечисленных этапов происходит сбой, количество тромбоцитов в периферической крови снижается. Развивается тромбоцитопения.
С учетом причин и механизма развития заболевание бывает разных форм:
Наследственные тромбоцитопении
Наследственная тромбоцитопения наблюдается при разных врожденных аномалиях. Ее причины — генетические мутации:
Продуктивные тромбоцитопении
К группе продуктивных тромбоцитопений относятся патологии системы кроветворения, связанные с нарушением процесса образования тромбоцитов в красном костном мозге. Причины заболеваний:
Тромбоцитопения разрушения
Причина тромбоцитопении в данном случае — усиленное разрушение тромбоцитов в селезенке (может быть также в лимфатических узлах, сосудистом русле или печени). Патология наблюдается при:
Возникает, если на поверхности детских тромбоцитов есть антигены, которых нет на материнских тромбоцитах. Антитела, вырабатываемые материнским организмом, поступают в кровоток новорожденного и разрушают его тромбоциты. Описанный процесс может длиться до 20 недели внутриутробного развития. В итоге ребенок может родиться с тромбоцитопенией.
Является следствием системных заболеваний — аутоиммунного гепатита, ревматоидного артрита, системной красной волчанки. Также синдром Эванса-Фишера может развиться на фоне относительного благополучия. Тогда говорят об идиопатической тромбоципении.
Попадая в организм, вирусы активно размножаются. На поверхности пораженных клеток образуются антитела, также изменяются собственные клеточные антигены. Пораженные клетки разрушаются в селезенке. Среди вирусов, способных вызвать тромбоципению — корь, краснуха, грипп, ветрянка.
Посттрансфузионные тромбоцитопении являются следствием переливания тромбоцитарной массы или крови. Для них характерно выраженное разрушение тромбоцитов в селезенке. Причина заболеваний состоит в попадании в организм во время переливания чужеродных тромбоцитов, к которым и начинают вырабатываться антитела.
Некоторые лекарства могут связываться на поверхности кровяных клеток с антигенами. К образовавшимся комплексам вырабатываются антитела, из-за чего тромбоциты начинают разрушаться в селезенке. Среди «провоцирующих» препаратов — «Хинидин», «Мепробамат», «Хлорохин», «Ранитидин», «Гепарин», «Циметидин», «Гентамицин», «Ампициллин» и др.
Идиопатическая тромбоцитопеническая пурпура
Идиопатическая тромбоцитопеническая пурпура (она же аутоиммунная тромбоцитопения или эссенциальная тромбоцитопения) характеризуется резким снижением уровня тромбоцитов в периферической крови. При этом состав других кровяных элементов не нарушается.
Причины
Почему возникает данная болезнь, неизвестно. Врачи говорят о наследственной предрасположенности и негативном действии следующих факторов:
На поверхности тромбоцитов имеются молекулярные комплексы — антигены. Если в организм попадает чужеродный антиген, иммунная система тут же начинает вырабатывать специфические антитела. Взаимодействуя с антигенами, они разрушают клетки, на поверхности которых находятся.
При эссенциальной тромбоцитопении в селезенке вырабатываются антитела к антигенам своих тромбоцитов. Они фиксируются на тромбоцитных мембранах и как бы помечают их. При прохождении через селезенку форменные элементы крови захватываются и разрушаются.
Из-за уменьшения количества тромбоцитов печень начинает их усиленного вырабатывать. Скорость созревания мегакариоцитов и образования из них тромбоцитов в красном костном мозге значительно увеличивается. Но постепенно компенсаторные возможности костного мозга истончаются, болезнь дает о себе знать.
Если диагностируется аутоиммунная тромбоцитопения при беременности, это значит, что антитела к собственным тромбоцитам проходят через плацентарный барьер и разрушают нормальные тромбоциты плода. В итоге ребенок может родиться больным.
Тромбоцитопения потребления
Тромбоциты активируются в сосудистом русле, запускается механизм свертывания крови. Из-за усиленного потребления тромбоцитов красный костный мозг начинает их активно продуцировать, и если причина патологии вовремя не будет устранена, их уровень в крови уменьшится до критической отметки.
К активации форменных элементов приводят:
Тромбоцитопения перераспределения
В норме в селезенке откладывается около 30% всех тромбоцитов. При некоторых заболеваниях орган сильно увеличивается в размерах, из-за чего в нем депонируется до 90% форменных элементов крови. Заболевание может быть вызвано циррозом печени, красной системной волчанкой, инфекциями, опухолями, алкоголизмом.
Тромбоцитопения разведения
Развивается у больных, которым переливают большие объемы плазмы, жидкостей, эритроцитарной массы, плазмозаменителей, не возмещая при этом тромбоциты. В итоге концентрация последних снижается до такого уровня, что даже их выброс из депо не способен поддержать нормальную работу свертывающей системы.
Симптомы тромбоцитопении
Механизм развития симптомов тромбоцитопении всегда одинаков. Из-за снижения концентрации тромбоцитов нарушается питание стенок кровеносных сосудов, увеличивается ломкость капилляров. В определенный момент по причине незначительного физического фактора или спонтанно целостность капилляров нарушается, возникает сильное кровотечение (его обычно изображают на фото тромбоципении). Нехватка тромбоцитов не дает образоваться тромбоцитарной пробке в лопнувших сосудах, поэтому кровь из циркуляционного русла изливается в окружающие ткани.
Основные симптомы тромбоцитопении:
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика
О наличии тромбоцитопении у детей и взрослых говорит уменьшение количества тромбоцитов в крови. Чтобы поставить точный диагноз и назначить качественное лечение проводятся дополнительные исследования, которые можно пройти в любой современной клинике гематологии:
Лечение тромбоцитопении
Лечением тромбоцитопении занимается гематолог. Сначала оценивается состояние пациента, изучается, насколько выражен геморрагический синдром.
Лечение тромбоцитопении с помощью лекарственных средств
Медикаментозное лечение при любой форме тромбоцитопении направлено на:
Обычно больным назначаются препараты:
Немедикаментозные методы лечения тромбоцитопении
Лечение тромбоципении может осуществляться с помощью терапевтических и хирургическим мероприятий. Наиболее часто гематологи прибегают к:
Лечение тромбоцитопении при беременности
Тромбоцитопения у беременных требует грамотного лечения. Обычно будущим мамам назначают короткие курсы глюкокортикостероидов («Дексаметазон», «Преднизолон»). В третьем триместре они ускоряют созревание легких плода, что делает возможным досрочное родоразрешение.
Если глюкокортикостероиды оказываются неэффективными, внутривенно вводится иммуноглобулин. За всю беременность его используют три-четыре раза, после еще раз сразу после родов. В неотложных ситуациях прибегают к переливанию тромбоцитарной массы.
Если все принятые меры не позволяют устранить симптомы заболевания, во втором триместре селезенку удаляют (особенно часто к операции прибегают, если диагностирована тяжелая степень гестационной тромбоцитопении в первом триместре). В идеале хирургическое вмешательство должно быть проведено лапароскопическим доступом.
Вопрос о родоразрешении всегда решается в индивидуальном порядке. Тромбоцитопения в родах может привести к сильному кровотечению, поэтому врачи тщательно взвешивают все «за» и «против». Менее травматичной для женского организма считается операция кесарева сечения.
Лечение тромбоцитопении народными средствами
Лечение тромбоцитопении проводится с помощью листьев крапивы, тысячелистника, земляники. Травы заваривают кипятком и пьют в охлажденном виде по 1/4 стакана 3-4 раза в день.
Хорошо зарекомендовало себя кунжутное масло при тромбоцитопении. Его следует принимать по столовой ложке 3 раза в день.
Диета
Специальной диеты для больных тромбоципенией не существует. Для предотвращения осложнений им следует соблюдать рекомендации:
Опасность
Осложнения тромбоцитопении часто угрожают жизни больного. Среди самых распространенных из них:
Профилактика тромбоцитопении
Профилактика тромбоцитопении возможна только в том случае, если известны ее причины. Так, например, если болезнь вызвана приемом лекарств, от них нужно отказаться. Если злоупотреблением спиртным — навсегда забыть об алкоголе.
Пациентам, которые перенесли тромбоцитопению, нужно раз в полгода сдавать общий анализ крови.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
За что отвечает костный мозг

Что такое костный мозг
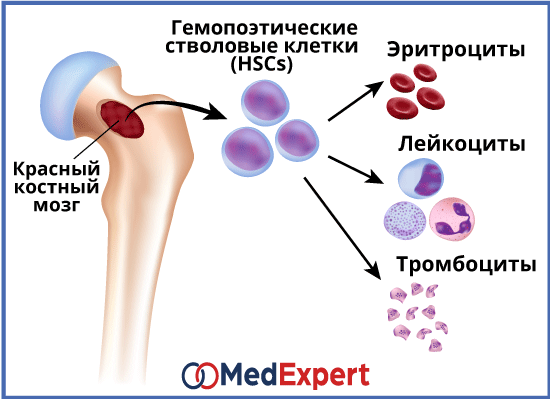
Костный мозг для кроветворной системы является важнейшим органом, ведь его главная функция – как раз осуществление гемопоэза, или кроветворения. Он непосредственно участвует в создании новых клеток крови взамен тех, что погибли, отмерли. Кроме того, единственной тканью взрослого человека, в которой содержатся незрелые клетки, известные также как стволовые, является именно костный мозг.
Костный мозг бывает двух типов: желтый, который представлен преимущественно жиром, и красный – основной орган кроветворения. В отличие от красного, желтый костный мозг не принимает участия в гемопоэзе.
Во время гемопоэза образуются клетки крови. Стартует гемопоэз в раннем эмбриональном периоде. Соответственно, существуют как эмбриональные кроветворные органы, так и те, что функционируют после рождения. К органам, которые отвечают за гемопоэз во время эмбрионального периода, относят желточный мешок, фетальную печень, селезенку и костный мозг. В желточном мешке появляются первые кроветворные стволовые клетки. Происходит это на 3-й неделе эмбриогенеза. Незадолго после, от 3-го месяца и до рождения, основным кроветворным органом плода становится печень, поскольку некоторые из стволовых клеток перемещаются туда. С 4-го же месяца эмбриогенеза начинается формирование клеток крови и в костном мозге. Кроме того, в кроветворении у плода участвуют тимус, лимфатические узлы и селезенка. В печени и селезенке сохраняются гемопоэтические стволовые клетки, находящиеся в «спящем» состоянии, чем часто объясняют факт возникновения за пределами костного мозга очагов кроветворения. Такое кроветворение называется экстрамедуллярным. Возникает оно при онкологических заболеваниях крови и в результате чрезмерной стимуляции гемопоэза.

Расположение гемопоэтической ткани у взрослого человека следующее: в костях таза ее больше всего – 40%, в телах позвонков значительно меньше – 28%, в костях черепа она составляет 13%, в эпифизах трубчатых костей и ребрах – 8%, в грудине меньше всего – только 2%. Оставшуюся часть костномозговых полостей занимает желтый костный мозг, являющийся, как вы помните, жировой тканью. При этом красный и желтый костный мозг находятся в равном соотношении: 1:1.
Структурно красный костный мозг подразделяется на: экстраваскулярный (собственно, гемопоэтическая ткань) и васкулярный, который состоит из широких венозных сосудов, называемых синусами. В сети ретикулиновых волокон внутри костных трабекул находится желеподобный дисперсный материал, который и является гемопоэтической тканью.
Кровоснабжение костного мозга называется перфузией. Его осуществляют основная питающая артерия и ее малые терминальные артериолы. Отток же крови происходит таким образом: по венозным капиллярам собирается кровь в центральный венозный синус через венозные сосуды. Стенки венозных сосудов состоят из следующих трех слоев клеток: адвентиции, базальной мембраны и эндотелия. Именно в ретикулуме – тонкой сети волокон соединительной ткани, образованной отростками адвентициальных клеток, располагаются кроветворные клетки. На объем гемопоэтического пространства влияют изменения в адвентициальных клетках: количество кроветворных клеток снижается, когда адвентициальные клетки увеличиваются из-за повышения содержания в них жира. Если рассматривать эту картину под микроскопом, она выглядит как трансформация красного костного мозга в желтый.
В тот момент, когда требования к кроветворению повышаются – адвентициальные клетки уменьшаются, тем самым способствуя увеличению гемопоэтического компонента костного мозга.
За что отвечает красный костный мозг

Гемопоэз объединяет два больших отдела кроветворения: лимфопоэз и миелопоэз.
Эритроциты, которые также называют «красные кровяные тельца» – клетки, не имеющие ядра, которым присуща форма двояковогнутого диска. Она поддерживается в эритроцитах благодаря спектрину (стабилизирующему белку мембраны). Размер эритроцита в норме колеблется между 7,5 мкм и 8,3 мкм, а продолжительность жизни составляет 90-120 дней. Всем известные основные группы крови (I, II, III, IV) выделяют на основании антигенных свойств эритроцитов. Функцию эритроциты выполняют чрезвычайно важную – они транспортируют дыхательные газы. Цитоплазма эритроцита заполнена гемоглобином на 96%. Это хромопротеид, состоящий из двух частей: глобина и гема. Первая является белковой, а вторая – небелковой и представляет собой комплекс протопорфирина IX и железа. Кислород из альвеол легких транспортируется к клеткам всего организма именно благодаря гемоглобину, и наоборот, от клеток к альвеолам – с помощью углекислого газа. В норме каждая молекула гемоглобина содержит две пары идентичных белковых цепей. Их обозначают буквами α и β из греческого алфавита. В зависимости от состава этих цепей различают три вида гемоглобина: эмбриональный, фетальный и гемоглобин взрослых.
В периферической крови помимо зрелых эритроцитов можно обнаружить молодые эритроциты – ретикулоциты. Это клетки без ядра, но содержат в себе большое количество РНК и рибосом, которые имеют мембранные рецепторы к трансферрину. РНК ретикулоцитов продолжает производить гемоглобин. На этой стадии возможна выработка гемоглобина до 30% от общего количества в эритроците. Большая же часть синтезируются на преретикулоцитных стадиях дифференцировки клетки – 70-80% гемоглобина. Когда ретикулоцит превращается в зрелый эритроцит, он больше не может производить гемоглобин, так как теряет РНК. В костном мозге эритроцит на стадии ретикулоцита находится в течение одного дня, а затем еще один день – в периферической крови.

Если специфическая зернистость отсутствует, лейкоциты называются агранулоцитами, а если присутствует – гранулоцитами. К первым относятся лимфоциты и моноциты.
Гранулоциты же отличаются между собой характером специфической зернистости и бывают трех видов:
Благодаря л ейкоцитам в организме реализуется защитная функция – иммунитет, который бывает специфический и неспецифический.
В одном из проявлений неспецифического иммунитета участвуют нейтрофилы, моноциты и тканевые макрофаги (в них превращаются моноциты после того, как выходят за пределы кровеносного русла). Они фагоцитируют (захватывают) с последующим лизисом (растворением) микробы, токсины и клеточный детрит (проще говоря, мусор). Эозинофилы обеспечивают защиту от паразитов и участвуют в аллергических реакциях (как и базофилы).
Лимфоциты осуществляют реакции специфического иммунитета, будь то врожденного или приобретенного. Специфический иммунитет, в свою очередь, бывает гуморальный и клеточный. Гуморальный иммунитет реализуется благодаря синтезу В-лимфоцитами иммуноглобулинов классов A, M, G, E, D; а клеточный – с помощью многообразных функций Т-лимфоцитов. Приобретенный иммунитет может формироваться естественным путем, вследствие различных инфекционных заболеваний, или в результате иммунизации организма.
Размеры лейкоцитов составляют от 6 мкм (малые лимфоциты) до 14 мкм (моноциты).
Лейкоциты отличаются между собой не только внешним видом и функцией, но и продолжительностью жизни. Так, например, длительность жизни лимфоцитов колеблется между несколькими часами и десятками лет. Моноциты циркулируют в крови на протяжении 72 часов, а потом выходят в ткани, где превращаются в фиксированные или мигрирующие макрофаги. Нейтрофилы находятся в крови 4-10 ч, с последующим выходом в ткани.
Тромбоциты – третий форменный элемент крови. Их приравнивают к истинным клеткам, хотя они и не являются таковыми. На самом деле, это частицы отшнуровавшейся цитоплазмы мегакариоцитов костного мозга, так называемые кровяные пластинки. Тромбоциты характеризуются свойствами агрегации (склеивания) и адгезии (прилипания). Их участие в механизмах свертывания крови и фибринолиза определяется наличием особых биологически активных веществ. Также они помогают поддерживать нормальную резистентность и функционирование микрососудов (ангиотрофическая функция). Размер тромбоцитов составляет 1-2 мкм, а продолжительность жизни – 8 суток.
За что отвечает желтый костный мозг
Желтый костный мозг обычно находится в диафизах трубчатых костей. Состоит из ретикулярной ткани и клеток адипоцитов, которые содержат специальный пигмент-липохром в центре полости длинных костей, а снаружи ее окружает слой красного костного мозга. Жир из адипоцитов, в случае крайней необходимости, например, после длительного голодания, организм может использовать в качестве источника энергии. В обычных условиях желтый костный мозг не участвует в гемопоэзе, но в исключительных случаях, например, после сильной кровопотери или при острой анемии, часть желтого костного мозга может превратиться в красный, чтобы ускорить восстановление крови.
Главные функции костного мозга

Недостаточная активность костного мозга может вызывать такие состояния как:
Кроме того, если вспомнить, что именно благодаря кровотоку все ткани и органы получают кислород и питательные вещества, то становится ясно: от костного мозга зависит абсолютно каждая клетка человеческого тела.
Также костный мозг – это стержневой элемент лимфатической системы. Все лимфоциты зарождаются именно в этой ткани. И если учесть, что иммунная система напрямую зависит от работоспособности лимфатической, то окажется, что без костного мозга не существовало бы и иммунитета. Большинство антител крови, которые защищают организм от патогенов, синтезируются именно в костном мозге.
Болезни костного мозга
Независимо от того, что вызвало повреждение ткани, особенно ее красной части – онкологическое заболевание или другие факторы – это всегда представляет угрозу для здоровья и жизни человека.
Миелопролиферативные расстройства
Нарушения со столь сложным названием возникают, если стволовые клетки размножаются неправильно. Таких заболеваний существует несколько типов:
Апластическая анемия

Апластическая анемия может быть приобретенной или врожденной. В первом случае стволовые клетки могут потерять способность превращаться в кровяные из-за воздействия токсинов, радиации или после тяжелых инфекционных заболеваний. Кроме того, эта болезнь иногда может проявляться как осложнение некоторых аутоиммунных нарушений, например, волчанки или ревматоидного артрита.
Лейкемия
Лейкемия, или “белокровие” – это вид рака, при котором в периферической крови появляется большое количество белых кровяных телец – лейкоцитов. Эти заболевания объединены под общим названием – гемобластозы.
Существуют такие принципы разделения гемобластозов:
Ученым трудно сказать, что именно вызывает лейкоз. Но принято считать, что повышают риск онкологических процессов в костном мозге облучение, влияние некоторых химических веществ, а также ряд генетических болезней.
Пересадка костного мозга: как, кому и зачем

Пересадка костного мозга – это, по сути, внедрение в организм пациента необходимых стволовых клеток. Стволовые клетки содержатся в эмбрионе, костном мозге, периферической крови человека, а также в пуповинной крови. Источником для пересадки могут служить все перечисленные варианты, кроме первого. Во время процедуры трансплантации собранные стволовые клетки внутривенно вводятся пациенту. После проникновения в кровоток донорские гемопоэтические стволовые частицы перемещаются в костный мозг больного, где, в случае удачно проведенной процедуры, начинают производить эритроциты, тромбоциты и лейкоциты.
На то, чтобы пересаженный материал прижился, обычно необходимо около 2-4 недель. Пересадка помогает больному организму восстановить способность самостоятельно производить необходимые элементы крови. К этой процедуре прибегают для лечения как онкологических, так и болезней другого типа.
Рассмотрим виды трансплантации костного мозга. Существует:
Возможные риски пересадки костного мозга
Несмотря на, казалось бы, простоту процедуры, на самом деле пересадка костного мозга не лишена серьезных рисков. После введение донорского материала у пациента может возникнуть реакция, которую называют «трансплантат против хозяина» (ТПХ). Это считается одним из самых опасных и самых частых осложнений после аллогенной пересадки. Суть реакции в том, что донорский костный мозг воспринимает организм реципиента как врага и начинает работать против него. Реакция «трансплантат против хозяина» случается почти в 40% случаев пересадки стволовых клеток. Это противостояние может привести даже к смерти реципиента. Считается, что риск возникновения реакции ТПХ увеличивается, если пациент старше 30 лет. В течение долгого времени врачи не брались пересаживать костный мозг людям в возрасте за 50, риск смертности после процедуры у них чрезвычайно высок. В наши дни к возрастному цензу врачи относятся уже с меньшей опаской.
Помимо реакции ТПХ, как осложнение на пересадку могут развиваться офтальмологические, эндокринные, легочные, неврологические, скелетно-мышечные, иммунные, инфекционные болезни, сердечная недостаточность, прогрессирование онкологического заболевания.
Эритроциты, лейкоциты, тромбоциты и компоненты лимфатической системы – все они производятся костным мозгом. О нем вспоминают редко и, как правило, только в случаях серьезных заболеваний. Костный мозг нельзя увидеть или прикоснуться к нему, а если с ним что-то не так, он не болит. Тем не менее это одна из наиболее важных тканей в организме и сбои в ее работе во многих случаях заканчиваются летальным исходом.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru