угловую форму имеет молекула
Угловую форму имеет молекула
**§3.6 Пространственная форма молекул.
Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна:
химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга.
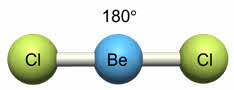
Поясним на конкретных примерах. В молекуле BeCl 2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
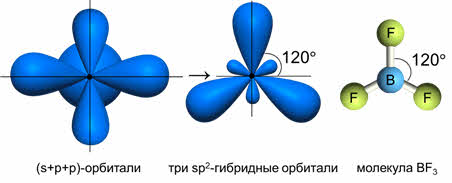
Другой пример: в молекуле BF 3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120 о :
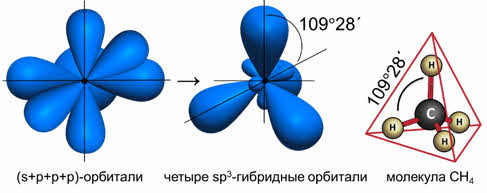
В молекуле CH 4 угол НСН такой же, как в математическом тетраэдре: 109 о 28’.
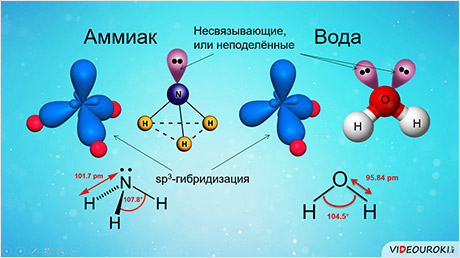
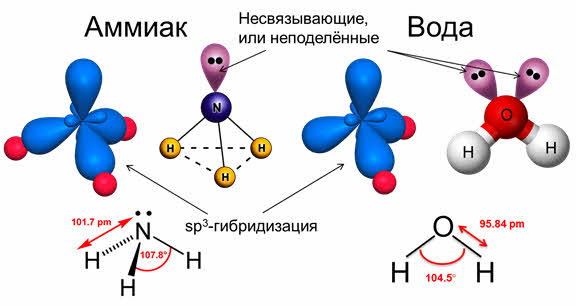
Последний пример: молекула H 2 O в своем составе имеет две связи O—H и две неподеленные пары электронов. Вывод: эта молекула также должна иметь форму, похожую на тетраэдр.
Теория отталкивания валентных электронных пар (ОВЭП) проста и наглядна. Она опирается на классическую геометрию и позволяет правильно предсказывать форму молекул.
Однако образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого понятия, как ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных орбиталей. Почему это понятие стало необходимо?
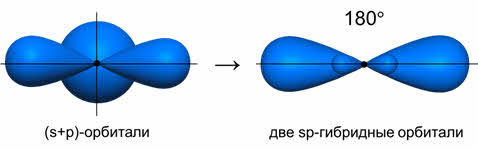
Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали (рис. 3-7).
Существует важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Если бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно, совершенно по-другому. Почему? На этот вопрос вы сможете ответить сами, когда прочтете о молекуле H 2 O в отдельной главе, посвященной воде и растворам.
Гибридизация атомных орбиталей. Геометрия молекул
Урок 10. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Гибридизация атомных орбиталей. Геометрия молекул»
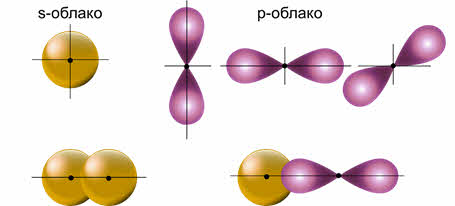
В образовании ковалентных связей принимают участие как эс-, так и пэ-электроны, орбитали которых имеют различную форму и направленность в пространстве.
Связи, которые образуются между ними, являются равноценными и расположены симметрично.
Это явление объясняется на основе концепции гибридизации атомных валентных орбиталей. Согласно концепции, в образовании химической связи принимают участие гибридные орбитали, то есть это орбитали, усреднённые по форме и размерам, а, следовательно, и по энергии. Число гибридных орбиталей равно числу исходных.
Гибридные орбитали более вытянуты в пространстве, а это обеспечивает их более полное перекрывание с орбиталями соседних атомов.
Из-за своей симметрии гибридные орбитали не участвуют в образовании пи-связи, так как не могут обеспечить перекрывание между собой в двух областях пространства.
Основными условиями устойчивой гибридизации являются:
Первое, в гибридизации могут участвовать орбитали с близкими значениями энергий, то есть эс-, пэ-орбитали внешнего энергетического уровня и дэ-орбитали внешнего или предвнешнего уровня;
второе, гибридная атомная орбиталь должна более плотно перекрываться с орбиталями другого атома при образовании связи;
третье, в гибридизации участвуют орбитали с достаточно высокой электронной плотностью, которыми в большинстве случаев являются орбитали элементов начальных периодов;
четвёртое, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга.
Ориентация гибридных орбиталей определяет геометрическую структуру молекулы. При комбинации одной эс- и одной пэ-орбитали возникает две эс-пэ-гибридные орбитали, расположенные симметрично под углом сто восемьдесят градусов.
Связи, образованные с участием электронов этих орбиталей, также располагаются под углом сто восемьдесят градусов.
Например, у атома бериллия эс-пэ-гибридизация орбиталей проявляется в молекуле хлорида бериллия, которая вследствие этого имеет линейную форму.
Комбинация трёх орбиталей (одной эс- и двух пэ-орбиталей) приводит к образованию трёх эс-пэ-два гибридных орбиталей, расположенных под углом сто двадцать градусов, как в молекуле фторида бора.
Комбинация четырёх орбиталей (одной эс- и трёх пэ-типа) приводит к эс-пэ-три гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырём вершинам тэтраэдра, то есть под углом сто девять градусов двадцать восемь минут, как в атоме углерода в молекуле метана.
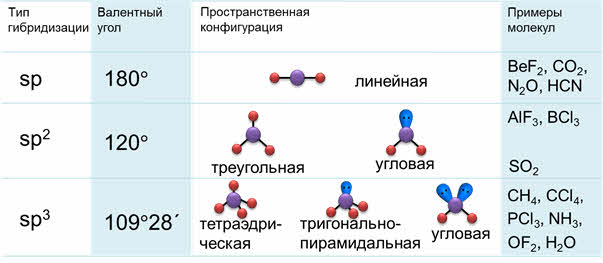
Таким образом, если исходными орбиталями являются эс- и пэ-, то образуется две гибридные орбитали, возникает гибридизация эс-пэ типа, связи при этом расположены под углом сто восемьдесят градусов, в пространстве молекула имеет линейное строение.
Если исходные орбитали одна эс и две пэ-орбитали, то образуется три гибридных орбитали, тип гибридизации при этом эс-пэ-два, валентный угол равен сто двадцать градусов, а форма молекулы треугольная.
Если в гибридизации участвуют одна эс и три пэ-орбитали
то образуется четыре гибридных орбитали, возникает эс-пэ-три гибридизация, валентный угол при этом сто девять градусов двадцать восемь минут, а форма молекулы тэтраэдрическая.
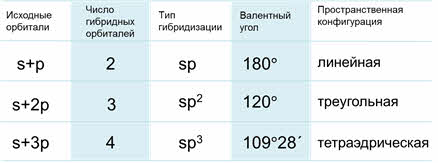
Основные характеристики разных типов гибридизации
Пространственное строение молекул или ионов зависит от типа гибридизации и взаимного расположения в пространстве гибридизированных орбиталей.
Часто в молекулах углы между связями отличаются от углов, соответствующих типу гибридизации. Почему же так происходит?
Во-первых, геометрическая конфигурация молекул определяется в основном пространственной направленностью сигма-связей. Устойчивому состоянию молекулы соответствует такое пространственное расположение электронных облаков валентного слоя, при котором их взаимное отталкивание минимально. Поэтому такие электронные пары стремятся максимально оттолкнуться друг от друга, располагаясь в пространстве под возможно большим углом.
Основными причинами отклонений углов связей от углов, соответствующих типу гибридизации являются:
во-первых, не все гибридные орбитали участвуют в образовании связей, часть из них – несвязывающие. Электронные пары, находящиеся на этих орбиталях, называются несвязывающими, или неподелёнными. Так, в молекуле аммиака у атома азота одна пара электронов – не связывающая, в молекуле воды у атома кислорода две пары электронов являются несвязывающими.
Связывающая электронная пара локализована между атомами и поэтому занимает меньше пространства, чем электронное облако несвязывающей пары. Поэтому отталкивающее действие несвязывающей пары проявляется в большей мере, чем связывающей. В молекуле воды и аммиака у атомов азота, и кислорода один и тот же тип гибридизации атомных орбиталей – эс-пэ-три. Однако из-за наличия одной у азота и двух у кислорода несвязывающих пар электронов идеальный угол для этого типа гибридизации, равный сто девять градусов двадцать восемь минут, уменьшается до ста семи градусов у аммиака и ста четырёх с половиной у воды.
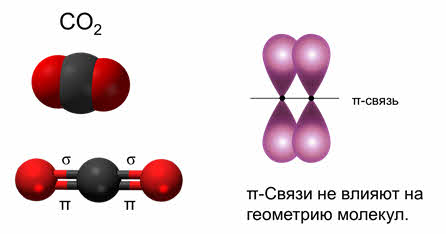
Второй причиной отклонений углов связей является наличие пи-связей, которые влияют на величину валентного угла, но это не сказывается на типе гибридизации и геометрии молекулы.
Предполагают, что электронные пары кратной связи занимают ту же область пространства, что и электронная пара простой связи. Суммарное электронное облако кратной связи занимает больший объём пространства, чем одинарной и поэтому обладает большим отталкивающим действием.
Так, в молекуле углекислого газа две ковалентные связи одинарные, так как являются сигма-связями, а две другие связи – это пи-связи. Пи-связи не влияют на геометрию молекул, поэтому в пространстве молекула углекислого газа имеет линейное строение, и здесь эс-пэ-тип гибридизации.
Виды геометрических конфигураций
Молекулы с эс-пэ-гибридизацией имеют линейное строение. Валентный угол при этом сто восемьдесят градусов. К таким молекулам относятся фторид бериллия, молекула углекислого газа, оксида азота один, синильной кислоты.
В молекулах с эс-пэ-два-гибридизацией валентный угол сто двадцать градусов, форма молекулы может быть треугольной, как у фторида алюминия, хлорида бора, так и угловой, как у молекулы оксида серы четыре.
В молекулах с эс-пэ-три-гибридизацией валентный угол сто девять градусов двадцать восемь минут. Молекулы могут иметь тэтраэдрическое строение, как молекула метана, тэтрахлорметана, а также тригонально-пирамидальное строение, как у хлорида фосфора три, аммиака, или угловое строение, как у фторида кислорода и воды.
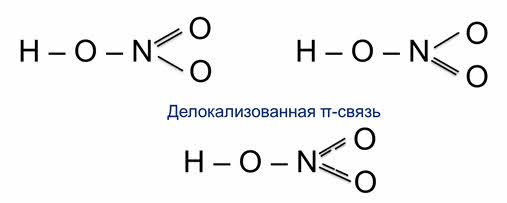
Иногда строение многих молекул нельзя изобразить такой одной графической формулой, потому что истинные свойства молекулы оказываются промежуточными между теми, которые отражаются в каждой отдельной схеме. Так, строение молекулы азотной кислоты можно изобразить двумя равнозначными графическими формулами. Так как в этой молекуле два атома кислорода равноценны, строение молекулы лучше отражает графическая формула с дэлокализованной пи-связью. Пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями. Эта электронная пара принадлежит не двум, а трём атомам, поэтому образованная таким образом связь является трёхцентровой.
Таким образом, гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга. Гибридные орбитали участвуют в образовании только сигма-связи.
Геометрия любой молекулы определяется пространственной направленностью сигма-связью. На пространственное строение молекулы оказывают влияние несвязывающие пары электронов, которые уменьшают углы связей между сигма-связями.
Химия. 11 класс
Конспект урока
Урок № 3. Пространственное строение молекул
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Дельта связь (δ) – связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками.
Двойная связь образуется при наложении π-связи на σ-связь.
Орбиталь – область наиболее вероятного местонахождения электрона в атоме (атомная орбиталь) или в молекуле (молекулярная орбиталь).
Пи связь (π) – связь, образованная перекрыванием атомных орбиталей по обе стороны от линии, соединяющей ядра атомов (боковые перекрывания).
Сигма связь (σ) – связь, образованная перекрыванием атомных орбиталей по линии, соединяющей ядра взаимодействующих атомов.
Тройная связь образуется при наложении двух π-связей на σ-связь.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Гибридизацией называют образование одинаковых по энергии и форме орбиталей атома в результате сложения различных по энергии и форме орбиталей при возбуждении этого атома. При этом орбитали разной симметрии смешиваются и переходят в гибридные атомные орбитали одинаковой формы и одинаковой усредненной энергии, что обеспечивает равноценность образуемых ими связей.
При смешении s и р-орбиталей образуется две sp-гибридных орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию. Такой тип гибридизации характерен для ацетилена, хлорида цинка, гидрида бериллия.
Форма гибридных атомных орбиталей отличается от формы исходных. В гибридной атомной орбитали электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с атомной орбиталью другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула – более устойчива.
Геометрическая конфигурация молекул полностью определяется типом гибридных орбиталей центрального атома только при условии, что все гибридные атомные орбитали участвуют в образовании связей. Если хотя бы на одной из них остается неподеленная электронная пара, то конфигурация, определяемая типом гибридизации, реализуется не полностью.
Таким образом, пространственная структура молекул зависит от типа гибридизации центрального атома и числа неподеленных пар. Образование p-связей стабилизирует состояние молекулы.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. При сгорании 4,00 г органического соединения образовалось 4,48 л углекислого газа (н.у.) и 2,88 г воды. Вещество обесцвечивает бромную воду и вступает в реакцию с раствором гидроксида бария при нагревании, один из продуктов имеет формулу: СxHyOz+…O2→x CO2+y/2 H2O. На основании данных условия задания:
1) проведите необходимые вычисления и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле.
Шаг 1. Определите количество вещества атомов углерода. Задание на ввод числа.
Шаг 2. Определите количество вещества атомов водорода. Задание на ввод числа.
Решение: n(Н) = 2n(Н2О) = 2m(H2O) / M(H2O) = 2×2,88г/18 г/моль = 0,32 моль
Шаг 3. Определите количество вещества атомов кислорода. Задание на ввод числа.
Решение: m(CxHyOz)= 0,20×12 + 0,32×1+ 16x = 4г, х = 0.08 моль
Шаг 4. Находим соотношение атомов углерода, водорода и кислорода. Определяем количество атомов углерода.
Задание на ввод числа.
Шаг 5. Находим соотношение атомов углерода, водорода и кислорода. Определяем количество атомов водорода.
Задание на ввод числа.
Шаг 6. Находим соотношение атомов углерода, водорода и кислорода. Определяем количество атомов углерода.
Задание на ввод числа.
Шаг 7. Составляем молекулярную формулу искомого вещества.