Как сделан спутник v
Вакцина «Спутник V»: инструкция, как испортить хорошее дело
Давайте на минуту отбросим все предубеждения и стереотипы об отечественной медицине и попробуем объективно разобраться в том, что сделано правильно, а что неправильно с «первой в мире вакциной от COVID» — Спутник V от «НИИ эпидемиологии и микробиологии им. Н. Гамалеи».
Поговорим о том, как устроена современная наука в целом и доказательная медицина в частности, и при чем тут пиар.
Доказательная медицина
Современным научным консенсусом является необходимость проведения клинических испытаний по вполне определенному протоколу. Клинические исследования в России систематически проходят с нарушением этого протокола, что приводит к широкому распространению препаратов «с недоказанной эффективностью» (ака «фуфломицины»).
Отечественный регулятор в лице Минздрава по разным оценкам либо игнорирует проблему, либо потворствует. Хрестоматийный пример — Арбидол. Препарат, показывающий антивирусную активность in-vitro (лат. «в стекле», т.е. в пробирке), но не имеющий доказанного терапевтического эффекта in-vivo (лат. «в живом» организме) ни при одной инфекции. Регулярные конфликты Минздрава и ФАС вокруг Арбидола привели (в том числе) к недавней отставке главы ФАС Артемьева.
Подорванный авторитет
Международное сообщество не слепое, и наблюдает это продолжительное время. Часто, даже извлекая из этого пользу. Так, тот же Pfizer на российском рынке зарегистрировал некоторые БАДы (пищевые добавки) в качестве лекарственных средств. То есть международные фармацевтические компании относятся к нашему рынку (и Индии тоже, например) как к «дикарям, на которых не грех срубить бабла».
Регуляторы
Частные фармкомпании с радостью рубили бы бабло не только в России, но в «цивилизованном» мире им мешают регуляторы. Самый строгий из них — американский FDA. Он не стесняется требовать от производителей лекарств всю (вот просто всю!) информацию и протоколы разработки и испытаний новых лекарств. И если что-то не сходится, не нравится, не соответствует принципам доказательной медицины, не является статистически достоверным, то просто отказывает. Яркий пример: препарат Талидомид, который был зарегистрирован в Европе, но отвергнут FDA. Во что это вылилось, почитайте в википедии.
Чтобы вы составили представление о степени серьезности FDA, перескажу такую байку:
Некая клиника в России получила кусочек глобального КИ наряду с другими странами, а сама разработка была американская. Соответственно, наряду с применением препарата проходит мониторинг состояния пациентов по заранее определенному графику, если соответствующие данные перестают поступать — пациент исключается из КИ. А заработок клиники зависит от числа пациентов, «зачтенных» по итогу КИ.
И вот как-то раз прилетает из FDA письмо, мол почему у вас в мониторинге у пациента ХХХ кардиограмма, как у 20-летнего, хотя по досье ему под 80 лет. Врачи, конечно, знали, почему, т. к. сами подсунули в результаты левую кардиограмму вместо непришедшего на регулярное обследования старикана, но регулятору отправили какую-то отписку. И в ответ на еще одно письмо, где регулятор писал, что такого быть не может — тоже. А в третий раз пришло уведомление, что ВСЕ результаты данной клиники исключаются из КИ, т. к. есть основания считать их недостоверными.
Особенности национальной науки
(тут и далее представлен мой субъективный взгляд)
Наша фармакология привыкла решать вопросы по допуску лекарств к рынку не в условиях жесткого регулирования, а в условиях «надо договориться с Минздравом, а протоколы нарисуем». Поэтому, когда встала необходимость выхода на международный рынок со своей вакциной и оказалось, что надо «по-взрослому» показывать все свои клинические испытания, сработала обычная неопытность. Больше всего опыта было в «рисовании» протоколов, а не в их ведении. В России это проблема не только медицины, а особенность менталитета и государствообразующий принцип в последние 100 лет — «красивая» бумажка начальнику. Фундаментальная наука какое-то время держалась, но потом сдалась под натиском «менеджеров», превратившись в такое же написание бумажек — отчетов по грантам. Медицина, как более коммерциализированная область, сдалась еще раньше.
Про НИИ им. Гамалеи
В научном сообществе мнение об этом НИИ довольно смешанное. С одной стороны, там действительно работают талантливые ученые и двигают современную науку. С другой — данное НИИ запятнало свою репутацию разработкой нескольких «фуфломицинов». В защиту же можно сказать, что эти фуфломицины разрабатывались не при том руководстве и не теми научными группами, которые разрабатывают «Спутник V». То есть условно «это было давно и неправда».
Про «Спутник V»
То была присказка, а теперь сказка. Судя по описанию, вакцина действительно инновационная и должна быть рабочая. Профессиональные инсайды также говорят, что «гамалея могёт». Поэтому начало вроде неплохое, если бы не несколько «но».
«Проверенная платформа»
Проверялась эта платформа на эболе точно так же сомнительно с точки зрения доказательной медицины. Никто в международном поле этого не проверял (хотя «приняли» ее довольно хорошо). Поэтому ее безопасность с точки зрения международного сообщества под вопросом. А значит в этом «клубе джентльменов» никто России на слово не поверит. Особенно с её-то репутацией.
«Первая вакцина»
Вакцина не первая, но действительно в числе первых. Надо помнить, что изготовленная в лаборатории партия — это даже не тестовое лекарство еще. Вторая фаза «Спутника» проходила одновременно с тремя другими вакцинами. Сейчас, одновременно со «Спутником» третья фаза идет примерно у десятка вакцин.
Проблемы второй фазы КИ
После опубликования в престижном и признанном международным сообществом журнале Lancet
результатов второй фазы, к ним возник ряд вопросов из-за статистической недостоверности некоторых данных (т. е. по-простому: пририсованности). Разработчики на это огрызнулись (вот реально другого слова не подберешь тут), что типа «у нас все верно, вы просто не умеете читать». Когда у них попросили исходные протоколы, НИИ Гамалеи отказался их предоставить в стиле «мы публикуем те данные, которые считаем нужными», чем только увеличил подозрения в реальности проведенных испытаний. Так вот: в уважаемом научном мире так не делается. У вас нет такого уровня доверия в этом мире, ребята. Его еще надо заслужить долгими годами безупречных исследований. Но и потом, когда джентльмена попросят показать карты, он должен не обижаться, а молча показывать.
Кто-то говорит, что сырые данные в итоге они показали, никак не афишируя. А афишировать такие вещи стоило бы в 21 веке. Потому что вы работаете в публичном поле. Пиар имеет самое непосредственное влияние не только на коммерческую успешность вашего решения, но и на восприятие научным сообществом в том числе.
Последующая «преждевременная регистрация» проведенная Минздравом и путаные объяснения с введением своей собственной нумерации клинических исследований только дополнительно подлили масла в огонь.
Проблемы третьей фазы
Как часто бывает в России, третья фаза тоже скатилась в го столкнулась с проблемами. Во-первых, уже на уровне отбора медучреждений возникло много проблем: просто нет у нас столько уважаемых международным сообществом клиник чтобы провести такое масштабное исследование. Поэтому пришлось набирать «из тех, кто был». Уровень доверия к этим данным можете представить сами, вспоминая вышеописанную байку.
Во-вторых, сами испытуемые, которые должны быть «ослеплены» (т.е. не знать, у кого препарат, а у кого плацебо) уже объединились в чатики и пошли массово сдавать анализы на антитела. Стоит ли говорить, что все «ослепление» после этого лишено смысла. Работать с такими статистически грязными данными невозможно, и все КИ надо начинать сначала, т.к. достоверно учесть расслепленных в таких условиях невозможно. Естественно, сделано этого не будет. К слову сказать, такой медицинский либерализм есть только у нас (и в Индии, конечно же). В Европе самостоятельно сдать анализ на антитела невозможно, а в США хоть и возможно, но скорее всего никому не придет в голову, т.к. сравнительно дорого. (UPD: в комментариях подсказывают, что я не прав)
Исправляется эта ситуация довольно несложно: введением единого реестра участников КИ и подключением лабораторий к этому реестру. В Европе и США такие реестры есть уже давно. Кроме того, каждый испытуемый подписывает обязательство не сдавать подобных анализов чтобы не быть исключенным из КИ. Это как раз свидетельство зрелости «рынка клинических исследований». В России такого реестра нет и пока не предвидится. То ли не догадались, то ли решили, что и «так сойдет», то ли решили просто что в ситуации, когда тесты свободно продаются в любой аптеке, делать это по большому счету бессмысленно.
Стоит отдельно упомянуть про анонсированные «92% эффективности». Это опять либо свидетельство непрофессионализма, либо намеренная попытка ввести в заблуждение. Проблема в этой цифре в доверительном интервале. Имеющиеся 20 случаев заболевания (если верить Гамалее на слово, т. к. протоколов нет) позволяют достоверно говорить об эффективности 26%-92% (UPD: цифра неточная!). То есть с уровнем доверия 95% эффективность лежит в этом интервале. Почему надо было озвучивать «92%» — вопрос для самостоятельного размышления.
Pfizer озвучил свои 90% только после набора 94 случаев. Потому что FDA поставил им минимальный промежуточный лимит — 92 (расчетное число), а не потому, что кому-то захотелось продать акции. Благодаря в т. ч. открытому промежуточному протоколу доверительный интервал можно самостоятельно посчитать: 81.1-95.4% с центром 91.7%. Озвучена оценка 90%. Как говорится, почувствуйте разницу.
Лучше уж доведите исследование до конца и опубликуйте нормальные статистически достоверные результаты, а не играйте в «догнать и перегнать америку». Для клинической применимости хватит и 50-60% эффективности.
Справедливости ради стоит еще заметить, что так как расслепление испытуемых приводит к изменению их поведения в предсказуемую сторону (группа плацебо становится более осторожной, а привитая вакциной, более рискующей), то искажение итоговых данных идет не в пользу разработчиков (т.е. доля заболевших среди привитых окажется несколько больше, чем в случае без расслепления). А значит разработчики вакцины — это самая заинтересованная в соблюдении регламента КИ сторона (при условии, что эффективность считается, а не рисуется).
Проблема масштабирования
В России просто нет таких свободных мощностей производства высокотехнологичных медицинских субстанций. Строить их долго и дорого. Это сейчас активно делается, даже несмотря на проблемы с закупкой оборудования (его сейчас всем не хватает).
Но до того как строить завод, надо отмасштабировать реакции. Между пробиркой и цистерной — пропасть длиною в годы. А контроль качества на каждом этапе будут осуществлять люди, которые раньше никогда этого не делали сами. Плюс все в спешке. Насколько у них это получится — вопрос без ответа.
По непроверенным слухам, пока проблема с масштабированием даже до полулитра готовой субстанции в лаборатории.
Медицина побед
Про название вакцины от НИИ им. Гамалеи уже все высказались. Это довольно наивная попытка эксплуатировать советский бренд 60-летней давности. Надо понимать, что иностранные партнеры не идиоты, и воспринимают этот неуклюжий брендинг (представьте на секунду, что американский фармпроизводитель начнет выводить на рынок прививку под брендом «Микки Маус — X»), как еще одно свидетельство оторванности от реальности общепринятых стандартов.
Но непрофессионализм пиарщиков гамалеи можно было бы простить, если бы не признаки того, что это название «спущено сверху». В пользу этого говорит массовое продвижение вакцины со стороны «ностальгически патриотически настроенного» политического истеблишмента и президента, в частности. А это уже значительно хуже. Потому что при политизации научного исследования исчезает возможность признать поражение неэффективность вакцины.
Напомню, что принципиальная возможность неудачи лежит в фундаменте всей современной науки (принцип фальсифицируемости). Потеря такой возможности переводит область исследования из науки в псевдонауку.
Из этого следует, что «Спутник V» теперь просто не имеет права провалиться (да с таким именем еще!). То есть в таких условиях клинические испытания могут быть объявлены успешными, независимо от фактических результатов (даже если производитель их реально посчитает).
А значит, что имея «на балансе» пиар-ошибки второй фазы КИ, и общий авторитет российских фармпроизводителей, доверия к вакцине, к сожалению, уже не вернуть. Даже если будут опубликованы детальные протоколы КИ (которые Pfizer, к слову, уже выкладывает, а наши опять по привычке скрывают), то скорее всего в них опять обнаружится куча несостыковок либо из-за неопытности, либо из-за «пририсовок».
Решением могло бы стать проведение независимых КИ в Европе и США на базе уважаемых клиник, но это долго, дорого и противоречит нашей общей идеологии «суверенной демократии науки». Так что все пока безрадостно, а «Спутник V» — это «вакцина Шрёдингера»: она как бы есть, но ее в то же время нет. Все зависит от наблюдателя и его убеждений. А это не соответствует критериям доказательной медицины.
Может ли «Спутник V» оказаться хорошей вакциной? Да, может. Пока все говорит о том, что она работает и серьезных побочек не имеет. Но героическая «медицина побед» с прививанием себя непроверенными препаратами, которая работала в 20 веке, в 21 веке уже выглядит диковато.
Плохой пиар, очень плохой
Несмотря на ковровое позитивометание со стороны отечественных СМИ, только 40% опрошенных заявили готовность привиться «Спутником», и только 25% врачей. Таким образом, даже массовая публика сказала «не верю!». А падкие на сенсации финансовые рынки вообще никак не отреагировали на новость от Гамалеи. Куда уж там до научного сообщества…
«Телевизор» не работает, ребята!
Заключение
Я все равно рад, что наша наука может рождать такие проекты. Я испытываю огромное уважение к ученым и медикам, которые искренне стараются сделать что-то действительно крутое и передовое даже по мировым меркам. И от того становится еще обиднее за то, что им приходится работать в обстановке такого непрофессионализма со стороны власти и руководства.
О Спутник V
О Спутник V
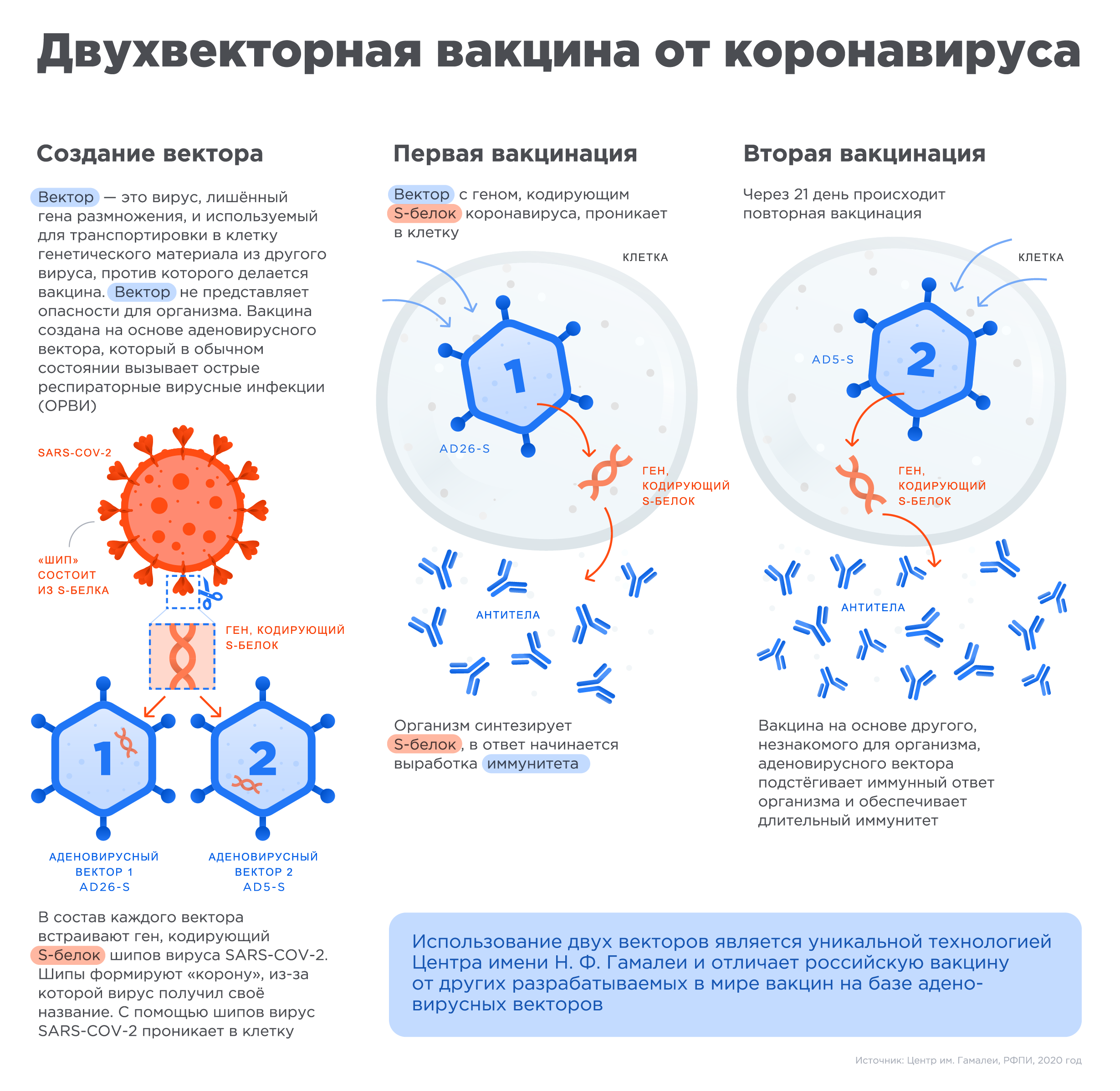
«Спутник V» — первая в мире зарегистрированная вакцина на основе хорошо изученной платформы вектора аденовируса человека. Она одобрена в 71 стране с общим населением 4 млрд человек.
Вакцина названа в честь первого советского космического спутника. Запуск «Спутника-1» в 1957 году дал новый импульс космическим исследованиям во всем мире, создав так называемый «момент Спутника» для мирового сообщества.
Эффективность вакцины составляет 97,6% по результатам анализа данных о заболеваемости коронавирусом среди россиян, привитых обоими компонентами препарата в период с 5 декабря 2020 года по 31 марта 2021 года.
Фаза 1 и 2 клинических испытаний вакцины были завершены 1 августа 2020 года. Итоги третьей фазы клинических испытаний в России опубликованы в журнале Lancet 2 февраля 2021 года. Клинические испытания третьей фазы «Спутник V» также успешно проходят в ОАЭ, Индии, Венесуэле и Беларуси.
Вакцина «Спутник V» создана на проверенной и хорошо изученной платформе аденовирусных векторов человека, которые вызывают обычную простуду и с которыми человечество сталкивалось на протяжении тысячелетий.
В вакцине «Спутник V» впервые среди вакцин против коронавируса был применен подход гетерогенного бустирования, в основе которого лежит применение двух разных векторов для двух уколов в процессе вакцинации. Такой подход формирует более стойкий иммунитет по сравнению с вакцинами, которые используют одинаковый механизм доставки для обоих уколов.
Безопасность, эффективность и отсутствие долгосрочных негативных последствий у аденовирусных вакцин доказаны в более чем 250 клинических исследованиях на протяжении двух десятилетий.
«Спутник V» не вызывает сильной аллергии.
Температура хранения на уровне +2+8 градусов Цельсия позволяет хранить вакцину в обычном холодильнике без необходимости инвестиций в дополнительную инфраструктуру холодовой цепи.
Как работают вакцины на основе аденовирусного вектора
«Векторы» являются носителями, которые могут доставить генетический материал из другого вируса в клетку. При этом генетический материал аденовируса, который вызывает инфекцию, удаляется и вставляется материал с кодом белка от другого вируса, в данном случае от шипа коронавируса. Этот новый элемент безопасен для организма, но он помогает иммунной системе реагировать и вырабатывать антитела, которые защищают от инфекции.
Технологическая платформа векторов на основе аденовирусов упрощает и ускоряет создание новых вакцин путем модификации исходного вектора-носителя генетическим материалом из новых появляющихся вирусов, что позволяет получать новые вакцины в сжатые сроки. Такие вакцины вызывают сильный ответ со стороны иммунной системы человека.
Человеческие аденовирусы считаются одними из самых простых для модификации, поэтому они стали очень популярными в качестве векторов.
Преимущества прайм-буст иммунизации

Безопасность и эффективность
После начала пандемии российские исследователи извлекли фрагмент генетического материала нового коронавируса SARS-COV-2, кодирующий информацию о структуре S белка шипа вируса (белок формирующего «корону» вируса и отвечающий за его связывание с клетками человека), и вставили его в уже знакомый им аденовирусный вектор для доставки в человеческую клетку, создав, таким образом, первую в мире вакцину против коронавируса SARS-COV-2.
Чтобы обеспечить длительный иммунитет, российские ученые предложили использовать два разных типа аденовирусных векторов для первой и второй вакцинации, усиливая действие вакцины.
Использование аденовирусов человека в качестве векторов безопасно, так как данные вирусы, вызывающие ОРВИ, не являются новыми и существуют уже тысячи лет.
Эффективность против новых штаммов
Вакцинация препаратом вырабатывает защитные нейтрализующие титры антител против новых штаммов, включая Alpha B.1.1.7 (впервые выявлен в Великобритании), Beta B.1.351 (впервые выявлен в ЮАР), Gamma P.1 (впервые выявлен в Бразилии), Delta B.1.617.2 и B.1.617.3 (впервые выявлены в Индии) и выявленных в Москве вариантов B.1.1.141 и B.1.1.317 с мутациями в рецептор-связывающем домене (RBD).Методология исследования основана на оценке вируснейтрализующей активности (ВНА) с применением живого вируса, что позволяет получить наиболее достоверные данные и является «золотым» стандартом. В ходе исследования сравнивалась ВНА сыворотки крови людей после вакцинации препаратом «Спутник V» на образцах штаммов, имеющих международное распространение, с ВНА против исходного штамма B.1.1.1. Сыворотка крови была собрана у лиц, иммунизированных обоими компонентами «Спутника V».
Полученные данные демонстрируют, что «Спутник V» сохраняет защитные свойства против новых штаммов. Снижение уровня вируснейтрализующей активности у препарата «Спутник V» к ряду штаммов оказалось значительно меньшим по сравнению с данными, опубликованными производителями других вакцин, которые ранее подтвердили эффективность своих препаратов против новых мутаций коронавирусной инфекции.
«Спутник» и ложь во спасение. Почему у работоспособной вакцины плохая репутация
Илья Ясный
руководитель научной экспертизы Inbio Ventures
«Спутник V» — вакцина, которая спасла немало жизней, и повод для гордости: Россия одна из немногих стран, справившаяся с самостоятельной разработкой. С другой стороны, процесс разработки, производства и распространения вакцины сопровождается таким количеством нарушений, дезинформации и некомпетентности, что репутация у препарата неоднозначная. Фактически в нем, как в капле воды, отразились проблемы российской науки, фармацевтики и пиара. Руководитель научной экспертизы Inbio Ventures Илья Ясный анализирует факты и домыслы вокруг «Спутника» и разбирается, почему Европа и ВОЗ до сих пор не одобрили российскую вакцину.
Дисклеймер: автор и его семья привились «Спутником».
Прежде всего, необходимо различать три вещи:
Предыстория: Эбола и уголовное дело
Публичная история Спутника V началась 20 апреля 2020 года, когда директор института Гамалеи Александр Гинцбург на совещании у Путина заявил, что клинические исследования вакцины могут начаться 1 июня, а регистрация возможна с 15 июня. Конечно, постановление правительства разрешает сокращенный порядок исследований лекарств в период пандемии, но две недели на клинические исследования — это, мягко говоря, оптимистичный прогноз.
Правда, Гинцбург и другие сотрудники постоянно ссылаются на то, что платформа, на которой сделан «Спутник», хорошо изучена, и это уже третья вакцина, полученная по данной технологии. Действительно, раньше в России была зарегистрирована вакцина от Эболы, однако сделано это было в нарушение всяких правил по результатам фазы ½, результаты фазы 3 так и не были нигде опубликованы, а разрешение на исследование вписано в реестр задним числом.
Есть еще одна пикантная подробность: на самом деле «Спутник» — не третья, а четвертая попытка института Гамалеи создать векторную вакцину: первой была АдеВак-Флю, о которой сейчас Гинцбург не упоминает. Возможно, потому что деньги на ее создание были разворованы, а в хищении 424 млн рублей у Роснано обвиняется бывший сотрудник центра Гамалеи Рустам Атауллаханов. Гинцбургу и его заместителю Денису Логунову посчастливилось быть на этом процессе свидетелями.
Поспешная регистрация
В мае 2020 года разразился скандал с исследованием вакцины на сотрудниках института Гамалеи еще до тестирования на животных. Директор Гинцбург заявил, что это не имеет никакого отношения к клиническим исследованиям. Правда, по всем международным правилам, незарегистрированные новые препараты должны вводиться людям только в рамках клинических исследований: они должны подписывать информированное согласие, оформлять страховку и тщательно наблюдаться, потому что их здоровье и жизнь подвергаются повышенной опасности.
Наконец, регистрация вакцины 11 августа без каких-либо опубликованных данных стала настоящей сенсацией не только у нас, но и за рубежом, и оказала неоднозначное влияние на имидж вакцины. Все, что было доступно в течение двух месяцев — скупые данные из плохо написанной инструкции, из которых, однако, было понятно, что обе дозы вакцины в жидком виде получили ровно двадцать человек. Это не тянет даже на исследование фазы 2, не то что на регистрационное. Для сравнения, на тот момент детали по первым двум фазам исследований западных вакцин: Pfizer/BioNTech, AstraZeneca, Moderna уже были опубликованы в рецензируемых научных журналах, причем там участвовало в десятки раз больше человек, но никто не торопился регистрировать вакцину по этим предварительным данным.
Кроме того, сопровождающие регистрацию заявления о том, что это первая в мире зарегистрированная вакцина от коронавируса, не соответствуют действительности: 25 июня китайская вакцина CanSino была зарегистрирована для применения у военных. Также нелепо заявление разработчика Логунова о том, что временная регистрация необходима для вакцинации групп риска. Оно противоречит и мировой практике, и российскому руководству по клиническим исследованиям.
Публикации и испытания
В сентябре 2020 года в журнале Lancet вышла публикация результатов исследований фазы 1/2, которая подверглась резкой критике со стороны итальянского борца с лженаукой Энрико Буччи и других ученых с обвинениями в фальсификации данных. Группа Логунова ответила на критику, однако первичные данные, по которым можно было с уверенностью судить об отсутствии фальсификации, так и не были предоставлены. Но и помимо этой критики в статье много недостатков. Некоторое беспокойство с этической точки зрения вызвало то, что в исследовании принимали участия военные — это зависимая группа, и необходима особая внимательность, чтобы обеспечить добровольность и информированность участников.
СТАТЬИ ПО ТЕМЕ
«Спутник» выходит из тени. Что прояснила статья в The Lancet о российской вакцине
В сентябре же началось исследование фазы 3. В отличие от всех ведущих производителей вакцин, протокол «Спутника» опубликован не был. Между тем протокол — это ключевой документ клинического исследования, в нем описывается схема эксперимента, заранее указывается, какой результат и по какому критерию исследователи считают успешным, сколько для этой цели нужно добровольцев и прочие подробности. Мне удалось ознакомиться с августовским черновиком протокола. На первый взгляд он неплохо написан и похож на протоколы западных компаний, однако есть некоторые важные нюансы: описание того, заболел человек ковидом или нет, недостаточно детально и довольно субъективно, что во многом оставляет решение за врачом. Это позволяет манипулировать данными, если знать, кто в группе плацебо, а кто — вакцины. При том, что вакцина чаще вызывает побочные реакции, такой подход может привести к завышению ее эффективности.
Решение, заболел участник исследования ковидом или нет, во многом остается за врачом
В протоколе «Спутника», в отличие от протоколов других компаний, отсутствовали промежуточные точки анализа. Между тем ждать 180 дней после включения в исследования последнего пациента — это и впрямь слишком долго, поэтому из публикации о фазе 3 мы узнаём, что промежуточные анализы были внесены туда в ноябре. Изменение протокола третьей фазы, когда исследование уже идет, может привести к получению невалидных результатов, и требуется большая осторожность и хорошие обоснования, что всё сделано правильно. Как нетрудно догадаться, в статье это никак не комментируется.
Неясна ситуация и с эффективностью «Спутника» против новых штаммов. В центре Гамалеи, конечно, утверждают, что он эффективен против них, не приводя никаких доказательств (ждите, мол, публикацию в мае). Независимые ученые проанализировали сыворотку привитых аргентинцев и установили, что она хуже нейтрализует южноафриканский вариант вируса.
Производство
Одновременно c фазой 3 начинается масштабирование производства вакцины и к процессу подключаются Генериум, Биокад, Р-Фарм и другие компании. Передача производства в коммерческие компании повысила надежду, что вакцина будет качественной, но одновременно поставила вопрос о сопоставимости продуктов, произведенных на разных площадках. Скажем, продукт, произведенный в институте Гамалеи в реакторах объемом 5 л для целей клинического исследования совсем не обязан быть таким же, как произведенный в Генериуме в реакторе 1000 л для массового применения. Их сопоставимость требует отдельных исследований. О неполной сопоставимости косвенно свидетельствуют разные указания о хранении и применении для продукта разных производителей в инструкции на препарат.
Дальше обещания по количеству доз постоянно обгоняли реальные темпы производства. Впрочем, в том, что производство не удалось сразу масштабировать, нет ничего удивительного — в России не было опыта самостоятельного производства и масштабирования качественных инновационных препаратов, а к закупке оборудования для масштабирования приступили только в конце сентября. Итого на 12 мая в России произведено 33 млн доз, из которых экспортировано 15 млн. Так, Мексика получила 1,9 млн доз из положенных по контракту 24 млн. Минздрав Мексики заявил, что это из-за проблем с производством второй дозы, но РФПИ утверждает, что это неверная информация.
Наконец, в конце ноября были объявлены предварительные результаты третьей фазы для всех ведущих вакцин, в том числе для «Спутника». Как и у Pfizer и Moderna, эффективность «Спутника» оказалась на уровне 95%. Данные были опубликованы в виде пресс-релизов, но для западных вакцин более подробная информация стала довольно быстро доступной после одобрения вакцин в США и ЕС — агентства на этих территориях, в отличие от Минздрава РФ, публикуют подробную информацию и от производителя, и от регулятора, а в США доступно еще и видео заседания научного комитета. Подробностей о «Спутнике» пришлось подождать до февраля 2021 года, когда вышла статья в журнале Lanсet о результатах фазы 3. Впервые результаты исследования третьей фазы российского препарата были опубликованы в таком престижном международном журнале. Правда, и к этой публикации у исследователей возникли вопросы, которые во многом могли бы быть сняты предоставлением протокола исследования и первичных данных. В частности, выяснилось, что реактогенность вакцины вовсе не изучали. По руководству после прививки нужно собирать информацию о реакции на вакцину в течение нескольких суток, опрашивая пациентов. В протоколе это не было предусмотрено.
Сопоставимость вакцин, произведенных на разных площадках, нужно отдельно исследовать
Тем не менее в ноябре-декабре 2020 года начали накапливаться сведения из Telegram-каналов о привитых «Спутником». И у пожилых, и у людей с сопутствующими заболеваниями не наблюдалось серьезных побочных эффектов, вырабатывались антитела. Это в итоге и убедило меня посоветовать родителям привиться. Конечно, такая ситуация ненормальна, источником достоверной информации о лекарствах должны быть не соцсети, а официальные данные.
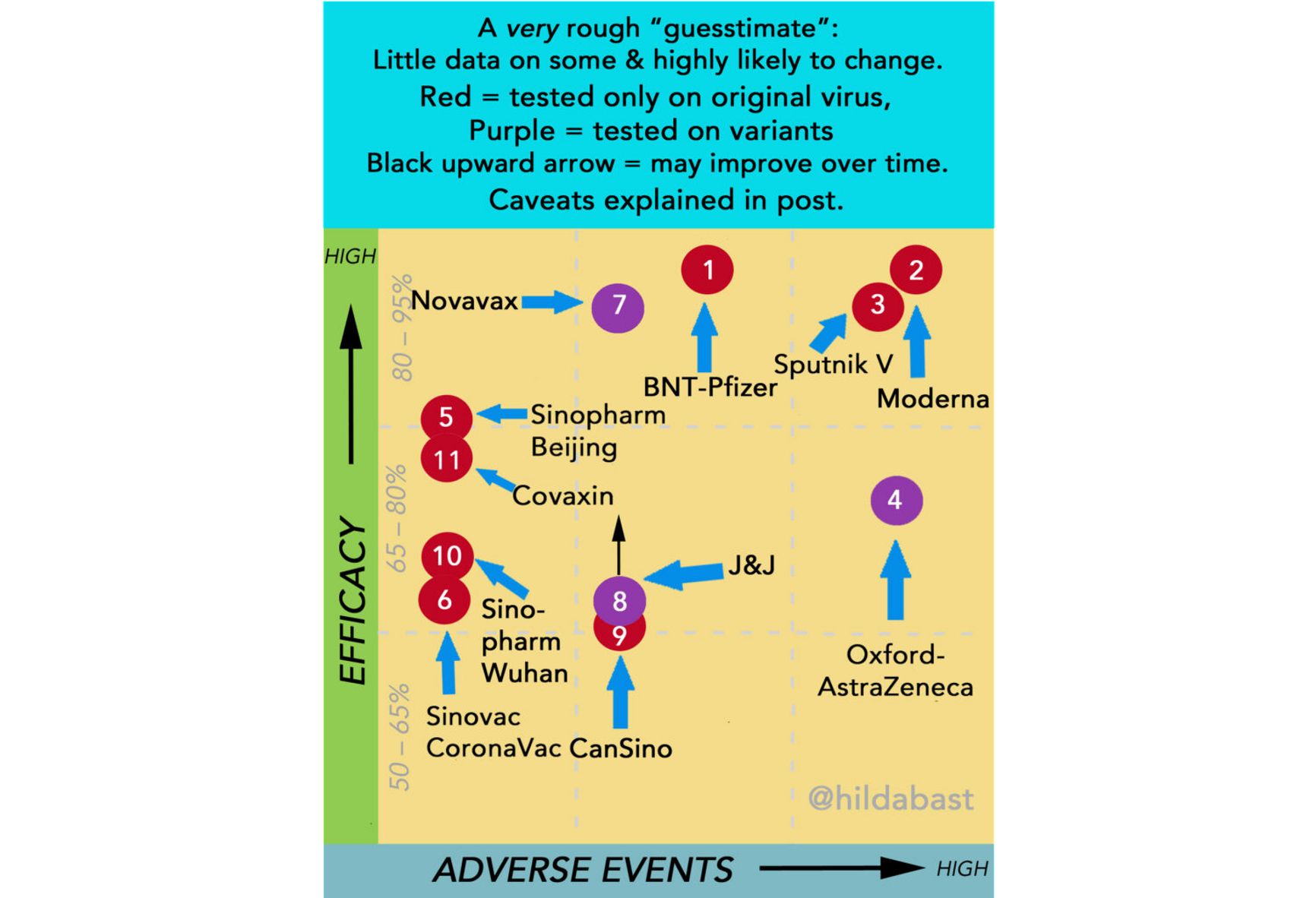
Правда, теперь у нас есть данные реального применения из Аргентины и Сан-Марино (но не из России). Надежно можно оценить разве что безопасность вакцины — количество побочных эффектов в сан-маринском исследовании находится на верхней границе других вакцин. Исследовательница Хильда Бастиан, одна из основателей Кокрейновского общества и эксперт по доказательной медицине, проводит сравнение вакцин по эффективности и безопасности, оговариваясь, что это ориентировочный график, потому что сравнивать данные из разных исследований напрямую не вполне корректно. На рисунке приведены данные на середину мая.
Как мы видим, у «Спутника» высокая заявленная эффективность, но и высокий уровень побочных эффектов. Число новых случаев ковида в Сан-Марино снизилось до нуля, при том, что «Спутником» там прививалось 80% населения.
Экспорт за рубеж
К «Спутнику» стали проявлять интерес в других странах — к ноябрю 2020 года заявки поступили из 50 стран на общий объем 1,2 млрд доз. Однако уже в декабре начались первые трения — Турция отказалась покупать «Спутник V» по причине несоответствия доклинических исследований надлежащей лабораторной практике (GLP, Good Laboratory Practice). Эти стандарты обеспечивают качественное выполнение исследований на животных, в первую очередь на токсичность. Если они не выполняются, нельзя быть уверенным, что препарат хорошо проверили на безопасность.
В ответ Гинцбург заявил, что «лабораторное производство сертифицировано по стандартам Минпромторга, но не по европейским сертификационным органам. У нас нет европейского сертификата, а имеем российский, как и вся наша промышленность». Это очень странный ответ — в претензии Турции речь шла вовсе не о производстве, а о доклинических исследованиях. Лабораторное производство не сертифицируется, лицензируется только промышленное производство. Стандарты лицензирования Минпромторга — это почти копия европейских стандартов.
Турция заявила, что проведет собственные исследования вакцины. Проделав это, турки одобрили вакцину 30 апреля и закупили 50 млн доз. Также они организуют собственное производство.
Вообще, для контекста важно понимать, что весь мир делится на две большие зоны — страны, где приняты самые современные нормы в отношении лекарств, разрабатываемые ICH (The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, Международный совет по гармонизации технических требований к лекарствам для медицинского применения), и остальные страны. Наиболее сильное и современное регулирование в США, ЕС, Японии, Швейцарии, Канаде. Важно подчеркнуть, что эти руководства — не бюрократические преграды на пути производителей, выстроенные злой «бигфармой», а стройная, научно обоснованная, выстраданная после многих инцидентов система, обеспечивающая население этих стран безопасными, эффективными и качественными лекарствами.
Две страны Евросоюза вступили в переговоры с РФПИ о поставках «Спутника», несмотря на отсутствие одобрения со стороны ЕМА и ВОЗ: Венгрия и Словакия. Венгрия одобрила вакцину еще в январе 2021-го, но продолжала свои внутренние проверки. В феврале началась массовая вакцинация населения. Со Словакией получилось сложнее: одобрение вакцины и решение о закупке «Спутника» привело к политическому скандалу внутри страны. Затем, получив первые образцы вакцины, словаки заявили, что они не соответствуют тому, что было опубликовано в The Lancet, а данных из досье недостаточно, чтобы судить о безопасности и эффективности вакцины.
В ответ РФПИ потребовал вернуть поставленные 200 000 доз, ссылаясь на нарушение словаками контракта, в соответствии с которым вакцину могли тестировать только в сертифицированных ЕС лабораториях. Тогда Словакия опубликовала контракт, из которого видно, что там нет таких указаний. Однако 9 мая Словакия сообщила, что дозы, отправленные на тестирование в Венгрию, оказались удовлетворительного качества, и 26 мая одобрила вакцину для применения в стране. А чешский регулятор ранее заявлял, что данных в досье недостаточно, и они прекращают рассмотрение документов.
Наверное, самый громкий скандал разразился в Бразилии. Тамошнее регуляторное агентство ANVISA заявило, что пока не разрешит регистрацию «Спутника V» по причине неполноты данных и сразу нескольких моментов, которые беспокоят агентство:
РФПИ пообещал подать на ANVISA в суд за клевету. Но часть этих замечаний была понятна и до ANVISA, и их в любом случае придется устранить до того, как ЕМА или ВОЗ одобрят вакцину. Если РФПИ и Гамалея хотят зарегистрировать вакцину в Евросоюзе (а им было выдано такое распоряжение, как говорится, «на самом верху»), им придется пустить аудиторов ЕМА даже на такой сверхсекретный объект, как центр Гамалеи.
Между тем в Бразилии местная компания União Química наладила собственное производство «Спутника» по лицензии и подала на регистрацию. Так же поступила и индийская Dr. Reddy’s, причем индусы еще и провели собственное клиническое исследование, а также налаживают самое масштабное производство «Спутника» в мире.
Пиар черный и белый
Тут самое время упомянуть о позиции, которую занимают пиарщики РФПИ при любой попытке критиковать вакцину и даже просто сравнить ее с другими аналогами. С самого начала фонд сделал ставку не на открытость и готовность к диалогу, а на защитно-агрессивную позицию, причем с акцентом на принижение достоинств других вакцин и безапелляционные заявления о 97-процентной эффективности «Спутника». Так, в пресс-релизе написано, что заболеваемость среди 3,8 миллионов привитых россиян в январе-марте 2021 года составила 0,027%. Это означает, что среди дважды привитых «Спутником V» заболело 1026 человек. При этом, согласно информации Мосгорздрава, около 1000 человек к 31 марта заболело только среди миллиона привитых москвичей. Противоречие в цифрах очевидно.
На все упомянутые выше сигналы из разных стран представители РФПИ отвечали, что это «фейк-ньюс», была подключена и риторика «информационной атаки» на «Спутник» со стороны Госдепа США и подконтрольных ему организаций. Правда, государственная пропаганда США дала повод: согласно отчету Департамента здравоохранения США за 2020 год, они «убеждали Бразилию отказаться от российской вакцины». Отчет стыдливо удален с сайта Департамента, но кэш всё помнит.
Что касается очернения конкурентов, самая вопиющая история — с табличкой из Венгрии. В Twitter РФПИ была опубликована таблица с заражениями и смертями после вакцинации различными препаратами, из которой можно сделать вывод, что после вакцинации Pfizer/BioNTech смертность в почти в 20 раз, чем после «Спутника».