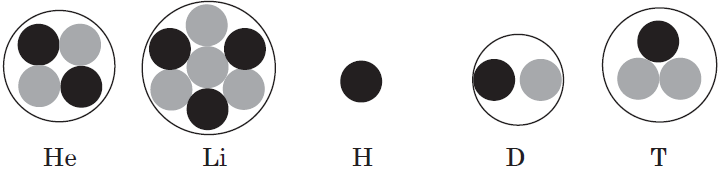
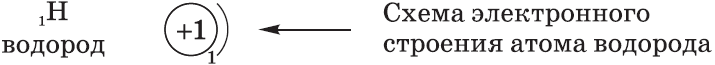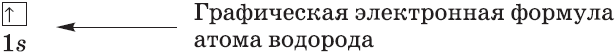Как рисовать электронную конфигурацию
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
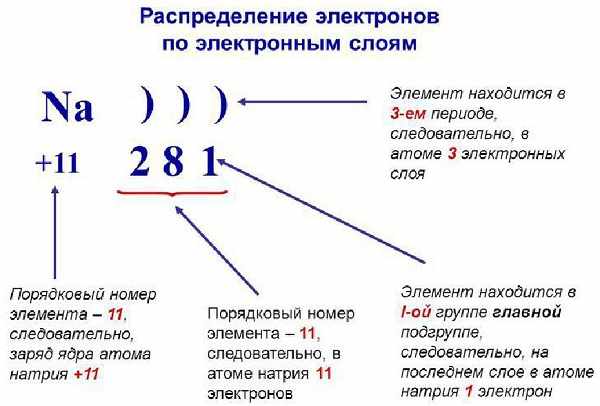
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
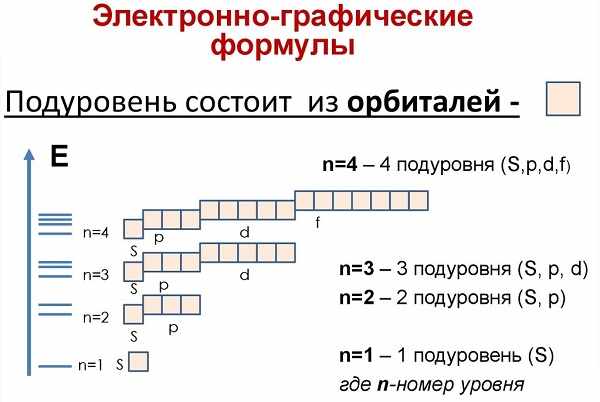
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
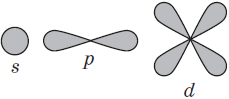
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
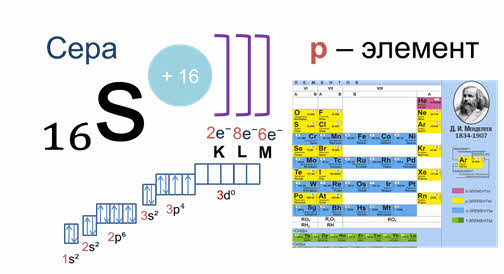
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
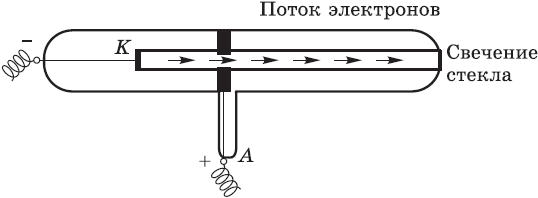
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
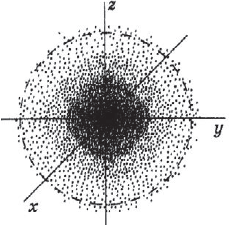
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
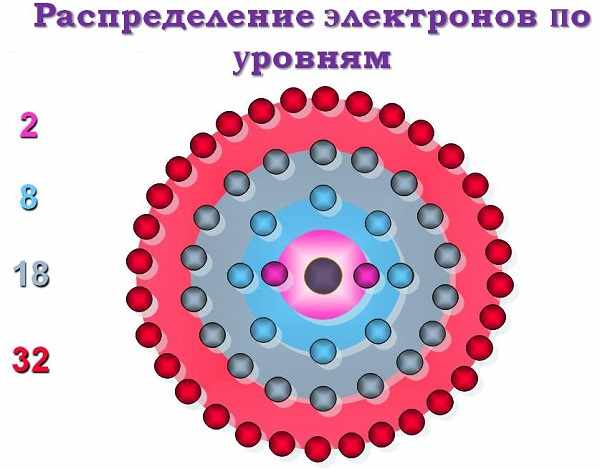
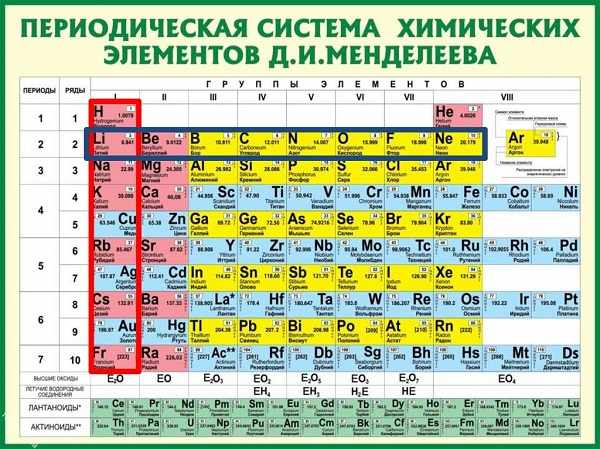
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
Как же устроен атом?
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
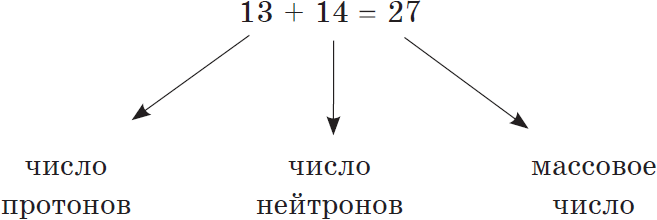
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Элементы первого периода.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
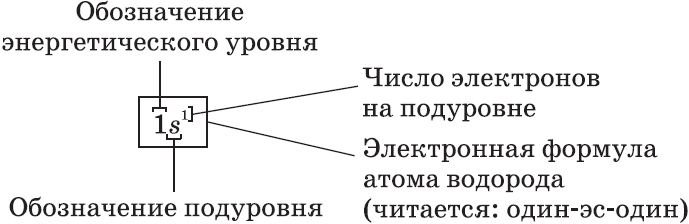
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.
Элементы второго периода.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<11> | 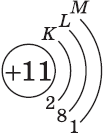 | $1s^2<2>s^2<2>p^6<3>s^1$ | 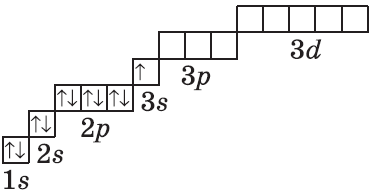 |
| $↙<13> | 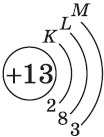 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^1$ | 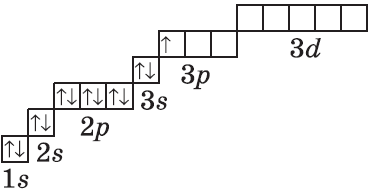 |
| $↙<18> | 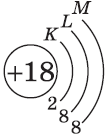 | $1s^2<2>s^2<2>p^6<3>s^2<3>p^6$ | 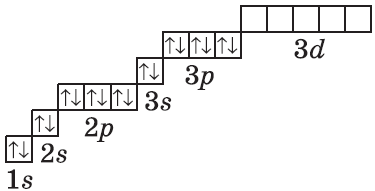 |
Элементы четвертого периода.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
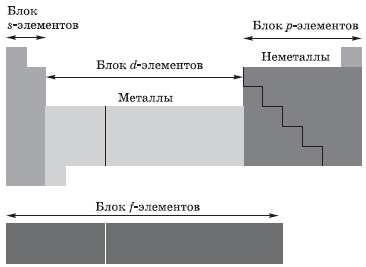
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
Электронная конфигурация атома. Основное и возбужденное состояние атомов
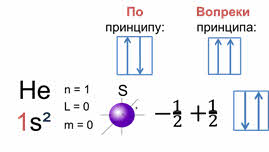
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
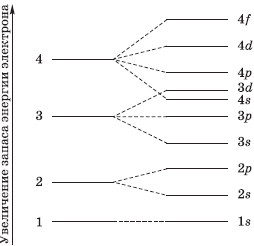
На рисунке показана схема деления энергетических уровней на подуровни.
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Электронная конфигурация атомов и ионов
В химии есть очень увлекательный, но сложный раздел – электронная конфигурация атомов и ионов.
Молекулу любого из элементов таблицы Менделеева можно изучить с точки зрения как физики, так и химии.
Дивный молекулярный мир на атомном уровне отличается от привычного. Разберем подробно, как образуется электронная формула элементов.
Строение «электронных» оболочек атомов
Для лучшего понимания электронных окружающих ядро оболочек, нужно знать об ионе – частице, в основе которой, кроме электронов, присутствуют так называемые протоны.
Если число протонов больше числа электронов, то такой атом называется катионом (положительный заряд). В противном случае атом называется анионом (заряд отрицательный).
Каждый из электронов занимает свой собственный уровень относительно ядра.
Конфигурация электронов для отдельно взятого атома может строиться в порядке атомных чисел. В качестве первоначального элемента выбирается водород, а далее продолжается добавление одного протона к ядру согласно с подсхемой и местом в периодической таблице, пока не опишутся все химические элементы.
Такая процедура называется принципом Aufbau (Ауфбау). Название принципа происходит от немецкого слова и переводится «построить».
Можно сделать вывод, что появление ионов связано с моментом, когда атомы получают или теряют заряды. Катион (положительно заряженный ион) образуется, когда один или несколько зарядов удаляются из «родительского атома».
Распределение электронных зарядов по уровням
Как уже говорилось выше, молекула любого элемента периодической таблицы – это своеобразный микрокосмос, где в разные стороны (спины) двигаются заряженные частицы (лептон). По-английски spin означает «вращение». Их полуцелые «спины» были описаны Вольфгангом Паули в 1925 году.
Всего принципов построения графических распределительных схем существует три:
Теперь рассмотрим состав «квартир» для лептонов. В зависимости от уровня и энергии, орбитальные места можно разделить на четыре формы:
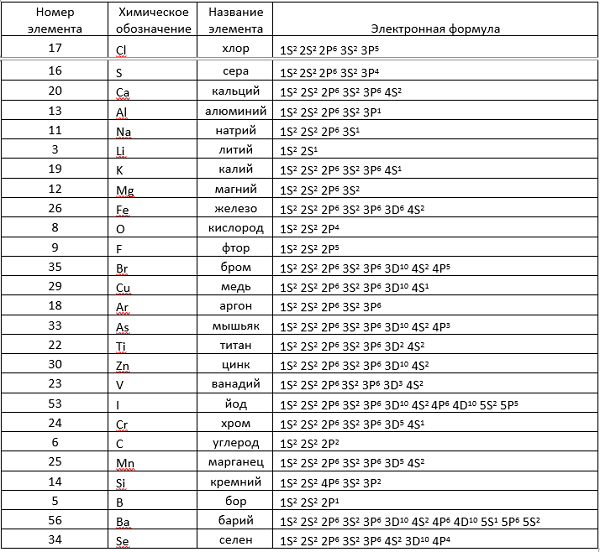
Электронные формулы химических элементов
Здесь приводится таблица-подсказка для некоторых химических элементов.
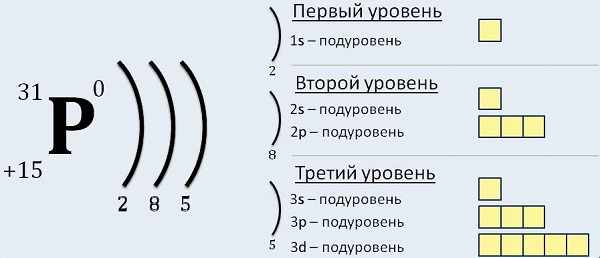
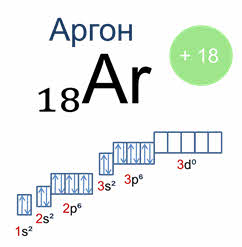
Теперь, руководствуясь данными таблицы, разберем электронные записи элементов на примере «аргона» (Ar).
В таблице Менделеева его номер восемнадцать. Руководствуясь описанным выше, высчитываем количество частиц (всего их 18).
Ещё до построения электронно-графической формулы Аргона, вспомним, как формируются орбитали и строятся ячейки:
Начинаем распределять электроны Ar:
Графическое изображение формулы аргона
Важно знать: непарные заряды во внешних орбиталях, называемые валентными зарядами, отвечают за большинство химических и физических проявлений элементов.
Заключение
Чтобы немного отстранится от научных теорий, стоит пофантазировать. Представьте атомное ядро и окружающие его заряды вселенной. Ядро – это солнце, а заряды планеты. Формула наглядно описывает положение подобных «планет» в космосе (атомного вещества). Чтобы перейти с одного уровня на другой, потребуется большая энергия.
В квантовой физике некоторые специалисты выдвинули теорию о том, что при вмешательстве в структуру атома можно сделать объект невидимым. Ведь если подумать, то фотон (мельчайшая частица света) может не вступать в связь с электронами атома и, не встречая сопротивления, преодолевать объект.
Впечатляет? Химическая формула элемента очень важна для физики. Благодаря труду Менделееву и его таблице, нам стали доступны современные технологии. Химические формулы и эксперименты скучны и сложны, хочется верить, что эта статья сделала их более понятными.
Электронные конфигурации атомов
Урок 3. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Электронные конфигурации атомов»
Общее число электронов равно заряду ядра атома, числу протонов в нем и соответственно атомному номеру элемента.
Например, у водорода атомный номер один, значит заряд ядра атома тоже плюс один, а протонов и электронов по одному.
Распределение электронов происходит в зависимости от энергии по энергетическим уровням, письменное выражение которых называется электронной формулой или электронной конфигурацией атома.
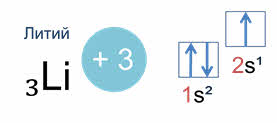
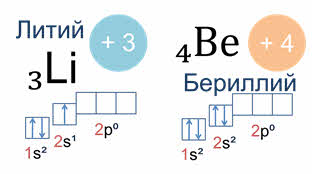
Например, у лития, элемента с атомным номером три, электронная конфигурация один эс два два эс один.
В этой конфигурации цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
Схематически электронное строение атома изображается с помощью электронно-графической схемы. Электронно-графическая схема атома лития:
Орбитали обозначаются клеточками, а электроны стрелочками. На первом энергетическом уровне на эс орбитали находятся два спаренных электрона, а на втором уровне на эс орбитали только один неспаренный электрон.
По принципу минимальной энергии, электрон занимает тот энергетический уровень, тот подуровень или ту атомную орбиталь, которым соответствует минимальный запас энергии. Это значит, что вначале заполняются те уровни, подуровни и орбитали, которые находятся ближе к ядру.
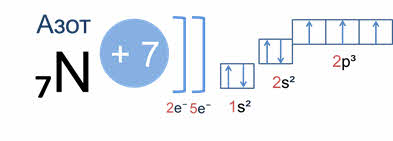
Например, у атома азота вначале заполняется одна эс орбиталь первого энергетического уровня двумя электронами, а затем второго энергетического уровня два эс орбиталь – двумя электронами и два пэ орбиталь того же уровня – тремя электронами.
Орбитали в атомах элементов первых трех периодов заполняются электронами в порядке увеличения их энергии.
В атоме не может быть двух электронов, у которых все четыре квантовых числа охарактеризованы одинаковыми значениями, так гласит принцип австрийского ученого Вольфганга Эрнста Паули.
Хотя бы одним значением квантового числа электроны должны отличаться. Из этого принципа следует следствие: на каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
В качестве примера рассмотрим электронную формулу атома гелия – один эс два. Главное квантовое число, которого равняется одному, значит, побочное квантовое число будет равняться нулю, и соответственно всего один подуровень эс и одна орбиталь в форме сферы. Магнитное орбитальное квантовое число также равно нулю, так как оно равно сумме значений положительного отношения один к двум и отрицательного отношения один к двум. А эс подуровень атома гелия заполняется всего двумя электронами. Поскольку на первом электронном слое могут находиться максимально только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчив.
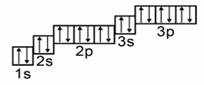
У атомов элементов второго периода начинает заполняться второй энергетический уровень, на котором может находиться максимально восемь электронов.
Так у атомов лития и бериллия электронами заполняется только два эс орбиталь.
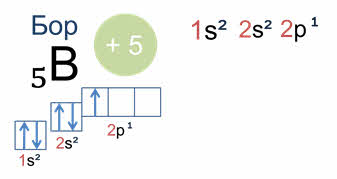
А у атома бора пятый электрон уже занимает одну из трёх два пэ орбиталей. Вот так выглядят электронная и электронно-графическая формулы атома бора.
Подуровень два пэ изображён вплотную к подуровню два эс, но несколько выше. Тем самым подчёркивается его принадлежность к одному и тому же уровню и одновременно больший запас энергии.
По правилу немецкого учёного Генриха Хунда в пределах определённого подуровня электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два. Однако в атоме имеются атомные орбитали с одинаковым запасом энергии, но расположенные на различных энергетических уровнях.
В таком случае применяем правило русского ученого Всеволода Маврикиевича Клечковского: энергия электронов в атоме определяется суммой значений главного и побочного квантовых чисел, поэтому, сначала заполняются электронами те энергетические уровни и подуровни, для которых сумма значений главного и побочных квантовых чисел минимальна.
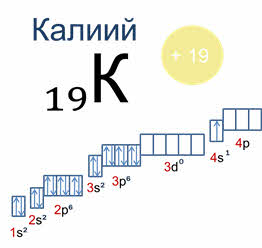
Рассмотрим первый элемент четвертого периода – калий.
У него появляется четвёртый электронный слой, открывающийся эс подуровнем. Однако в третьем периоде был только завершен подуровень пэ у аргона.
Возникает вопрос: вначале будет заполняться три дэ или четыре эс подуровень? На три дэ подуровне сумма главного и побочного чисел равна пяти. А сумма главного и квантового чисел четыре эс подуровня равна четырем. Приходим к выводу, что четыре меньше пяти.
Значит энергия подуровня четыре эс несколько меньше, чем подуровня три дэ.
Заполняется первым четыре пэ подуровень или три дэ подуровень, если значения сумм главного и побочного квантовых чисел на двух подуровнях равны пяти? Вспомним принцип минимальной энергии: энергия на три дэ подуровне меньше, чем на четыре пэ, следовательно, вначале будет заполняться три дэ подуровень.
Поэтому в этом случае только после того как заполнился четыре эс подуровень, начинает заполняться электронами дэ подуровень третьего, теперь уже предвнешнего, энергетического уровня.
В атоме каждый электрон располагается так, чтобы его энергия была минимальной, что отвечает наибольшей связи его с ядром. А энергетические уровни и подуровни выражаются общей формулой распределения, но необходимо не забывать при заполнении все правила и принципы электронной конфигурации атомов.
Рассмотрим, как происходит заполнение электронами атомов элементов второго и третьего периодов.
У элементов второго периода согласно принципу минимальной энергии, вначале заполнится первый энергетический уровень, а затем будет заполняться по принципу Паули, правилу Хунда – второй энергетический уровень.
На втором энергетическом уровне максимально может находиться только восемь электронов, поэтому электронный слой атома неона является завершенным и очень устойчивым.
В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами эс подуровень у натрия и магния, а затем пэ подуровень у алюминия, кремния, хлора и аргона. В атоме аргона на внешнем электронном слое находится восемь электронов.
Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более восьми электронов. Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой число электронов на уровне равно произведению два на эн в квадрате максимально на нём может находиться 18 электронов: восемь на эс и пэ-подуровнях и десять на дэ подуровне.
В зависимости от того, на какой атомной орбитали находится последний электрон, химические элементы можно разделить на следующие семейства: эс, пэ, дэ, эф.
Принадлежность химического элемента к тому или иному электронному семейству можно определить по электронной конфигурации, которая показывает расположение электронов на энергетических уровнях и орбиталях атомов. Записать такую формулу можно с помощью периодической системы Дмитрия Ивановича Менделеева. Для элементов малых периодов, состоящих только из главных подгрупп, это совсем не сложно. Например, сера, элемент номер 16 расположенный в третьем периоде, главной подгруппе шестой группы. Следовательно, ядро ее атома имеет заряд плюс 16, на электронной оболочке, которой располагается 16 электронов. На первом уровне 2 электрона на один эс орбитали, на втором уровне два электрона на два эс орбитали и 6 электронов на два пэ орбитали. На третьем уровне два электрона на три эс орбитали, четыре электрона на три пэ орбитали. Значит сера — это элемент, относящийся к пэ семейству, потому что последний ее электрон располагается на три пэ орбитали.
Для элементов побочных подгрупп следует учитывать тот факт, что у атомов этих элементов строится не внешний уровень. На нем, как правило, будут находиться не два эс электрона, а дэ орбитали предвнешнего уровня. На них может поместиться не более десяти электронов.
Например, строение электронной оболочки элемента номер 22 титана, который расположен в четвертом периоде побочной подгруппы IV группы Периодической системы Дмитрия Ивановича Менделеева.
Следовательно, ядро его атома имеет заряд плюс 22 и на электронной оболочке находятся 22 электрона: на первом уровне два электрона на один эс орбитали, на втором уровне восемь электронов, на два эс орбитали два электрона и шесть электронов на два пэ орбитали. На внешнем, четвертом – два эс электрона как у элемента побочной подгруппы, и остальные 10 электронов – на третьем уровне (два на три эс орбитали, шесть на три пэ орбиталях и оставшиеся два на три дэ орбиталях). Значит титан это дэ элемент, так как последний электрон в его атоме располагается на незавершенной – три дэ орбитали.
Распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем. Для правильного заполнения атомных орбиталей электронами необходимо применять принцип минимальной энергии, принцип Паули, правило Хунда и правило Клечковского.