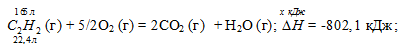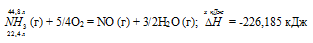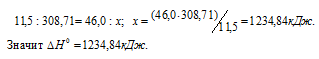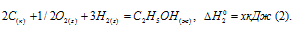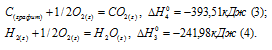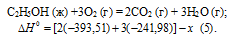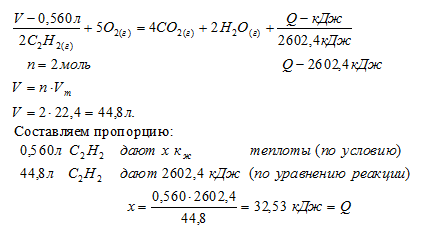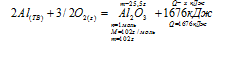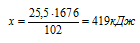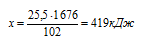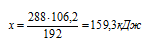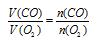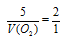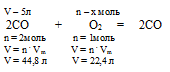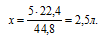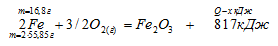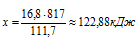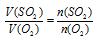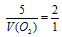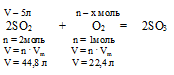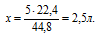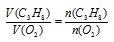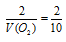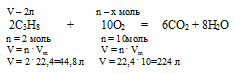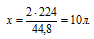Как решаются термохимические уравнения
Как решаются термохимические уравнения
Чтобы вскипятить чайник, требуется 315,2 кДж теплоты. Сколько граммов угля надо сжечь, чтобы получить такое количество теплоты? Примите, что уголь — это чистый углерод. Термохимическое уравнение сгорания углерода имеет вид
Ответ дайте в граммах и округлите до десятых.
Из пропорции получаем:
Чтобы нагреть воздух в двухкомнатной квартире на один градус, требуется 250 кДж теплоты. Сколько литров метана (н. у.) надо сжечь, чтобы получить такое количество теплоты? Термохимическое уравнение сгорания метана имеет вид
Ответ округлите до целых.
Из пропорции получаем:
Синтез аммиака протекает в соответствии с термохимическим уравнением реакции
Определите количество теплоты (кДж), которое выделится в результате образования 560 мл (н. у.) газообразного аммиака. (Запишите число с точностью до сотых.)
Из пропорции получаем:
Из предложенного перечня выберите все экзотермические реакции.
1) гашение оксида кальция водой
2) термическое разложение нитрата серебра
3) нейтрализация соляной кислоты гидроксидом калия
4) синтез аммиака из простых веществ
5) синтез глюкозы из углекислого газа и воды
Запишите номера выбранных ответов в порядке возрастания.
Реакции 1 и 3 являются кислотно-основными, а значит экзотермическими. Экзотермической также является реакция синтеза аммиака.
В соответствии с термохимическим уравнением
для получения 10,8 г серебра необходимо затратить теплоту в количестве
Тепловой эффект реакции в термохимическом уравнении связан с количествами вещества в соответствии с уравнением реакции. На примере этой реакции: 317 кДж затрачивается на разложение 2 моль AgNO3, образование 2 моль Ag, 2 моль NO2 и 1 моль О2.
Находим молярную массу серебра (по периодической системе). M(Ag)=108 г/моль. Из уравнения реакции видно, что образуется 2 моль серебра. Находим массу m=nM, где n-количество вещества:
m=108 г/моль*2 моль=216 г. Значит, для образования 216 г серебра потребовалась теплота 317 кДж.
Термохимические уравнения. лекция. практические задания
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
Задача 1. Определите количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, с помощью термохимического уравнения.
2 Mq + O 2 = 2 MqO + 1204 кДж
1) Определяем количества оксида магния, используя формулу для нахождения количества вещества через массу.
n ( MqO ) = 120г/ 40 г/моль = 3 моль
2) Составляем пропорцию с учетом коэффициентов в уравнении реакции
Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:




Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
Ответ: 452,37 кДж
Тепловой эффект реакции
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Сравнивая уравнения (1) и (5), находим:
Качественные задачи на расчеты по термохимическому уравнению
Задача 1.
При сгорании 560 мл (н.у.) ацетилена согласно термохимическому уравнению:
2С2Н2(Г) + 5О2(г) = 4СО2(Г) + 2Н2О(Г) + 2602,4 кДж
выделилось:
1) 16,256 кДж; 2) 32,53кДж; 3) 32530 кДж; 4) 16265кДж
Дано:
объем ацетилена: V(С2Н2) = 560 мл.
Найти: количество выделившейся теплоты.
Решение:
Для выбора верного ответа удобнее всего провести расчет искомой в задаче величины и сравнить ее с предлагаемыми вариантами. Расчет по термохимическому уравнению ничем не отличается от расчета по обычному уравнению реакции. Над реакцией мы указываем данные в условии и искомые величины, под реакцией — их соотношения согласно коэффициентам. Теплота представляет собой один из продуктов, поэтому ее числовое значение мы рассматриваем как коэффициент.
Сравнивая полученный ответ с предложенными вариантами, видим, что подходит ответ № 2.
Небольшая хитрость, приводящая невнимательных учеников к неверному ответу № 3, заключалась в единицах измерения объема ацетилена. Объем, указанный в условии в миллилитрах, обязательно нужно было перевести в литры, так как молярный объем измеряется в (л/моль).
Изредка встречаются задачи, в которых термохимическое уравнение необходимо составить самостоятельно по значению теплоты образования сложного вещества.
Задача 1.2.
Теплота образования оксида алюминия равна 1676 кДж/моль. Определите тепловой эффект реакции, в которой при взаимодействии алюминия с кислородом получено
25,5г А12О3.
1) 140кДж; 2) 209,5кДж; 3) 419кДж; 4) 838кДж.
Дано:
теплота образования оксида алюминия: Qобр (А12О3) = = 1676 кДж/моль;
масса полученного оксида алюминия: m(А12О3) = 25,5 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию образования оксида алюминия из А1 и О2. При расстановке коэффициентов в полученном уравнении учитываем, что перед А12О3 должен быть коэффициент «1», который соответствует количеству вещества в 1 моль. В этом случае мы можем использовать теплоту образования, указанную в условии:
2А1(ТВ) + 3/2О2(г) → А12О3(ТВ) + 1676 кДж
Получили термохимическое уравнение.
Для того чтобы коэффициент перед А12О3 остался равен «1», коэффициент перед кислородом должен быть дробным.
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании 25,5 г А12О3:
при получении 25,5 г А12О3 выделяется х кДж (по условию)
при получении 102 г А12О3 выделяется 1676 кДж (по уравнению)
Подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 1676 кДж выделяется при образовании 1 моль А12О3. Масса 1 моль А12О3 составляет 102 г, следовательно, можно составить пропорцию:
1676 кДж выделяется при образовании 102 г А12О3
х кДж выделяется при образовании 25,5 г А12О3
Подходит ответ № 3.
Ответ: Q = 419кДж.
Второй вид задач можно решать как по закону объемных отношений, так и без его использования. Рассмотрим оба варианта решения на примере.
Задачи на применение закона объемных отношений:
Отношение 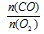
V(CO) возьмем из условия. Подставив все эти значения в закон объемных отношений, получим:
Отсюда: V(O2) = 5/2 = 2,5л.
Подходит ответ № 3.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
Составляем пропорцию:
5 л С02 взаимодействуют с х л О2 (по условию) 44,8 л СО2 взаимодействуют с 22,4 л О2(по уравнению):
Получили тот же вариант ответа № 3.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.
Тепловой эффект реакции. Вычисление объема газа по термохимическому уравнению
Задача 1.11
Теплота образования оксида железа (III) равна 817 кДж/моль. Определите тепловой эффект реакции, в которой из 16,8 г железа и необходимого количества кислорода образовался Fe2О3.
1) 245,1кДж; 2) 2723кДж; 3) 122,55 кДж; 4) 367,65 кДж.
Дано: теплота образования оксида железа (III) равна: Qобр (Fe2О3) = 817 кДж/моль;
масса потраченного железа: m (Fe) = 16,8 г.
Найти: тепловой эффект.
Решение:
Данный тип задач можно решить двумя способами:
I способ
Согласно определению теплота образования сложного вещества — это тепловой эффект химической реакции образования 1 моль этого сложного вещества из простых веществ.
Записываем реакцию оксида железа (III) из Fe и О2. При расстановке коэффициентов в полученном уравнении учитываем, что перед Fe2О3 должен быть коэффициент «1», который соответствует количеству вещества в 1 моль. В этом случае мы можем использовать теплоту образования, указанную в условии:
Получили термохимическое уравнение.
Для того чтобы коэффициент перед Fe2О3 остался равен «1», коэффициент перед кислородом должен быть дробным (3/2).
При записи термохимических уравнений допускаются дробные коэффициенты.
Рассчитываем количество теплоты, которое выделится при образовании Fe2О3 из 16,8 г Fe:
при использовании 16,8 г Fe выделяется х кДж (по условию)
при использовании 111,7 г Fe выделяется 817 кДж (по уравнению)
Ближе всего подходит ответ № 3.
При решении последней задачи в условиях ЕГЭ можно было не составлять термохимическое уравнение. Рассмотрим этот способ.
II способ
Согласно определению теплоты образования 817 кДж выделяется при использовании 111,7 г Fe. При использовании 16,8 г Fe выделяется х кДж, следовательно, можно составить пропорцию:
817 кДж выделяется при при использовании 16,8 г Fe
х кДж выделяется при использовании 111,7 г Fe
Ответ: Q = 122,88 кДж.
Применяем закон объемных отношений:
Отношение 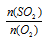
Отсюда: V(O2) = 5/2 = 2,5л.
Подходит ответ № 1.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
5 л SO2 взаимодействуют с х л О2 (по условию)
44,8 л SО2 взаимодействуют с 22,4 л О2(по уравнению)
Получили тот же вариант ответа № 1.
Ответ: V(O2) = 2,5л.
Применяем закон объемных отношений:
Отношение 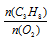
Отсюда: V(O2) = 2 . 10/2 = 10л.
Без использования закона объемных отношений задача решается с помощью расчета по уравнению:
2 л С3Н8 взаимодействуют с х л О2 (по условию)
44,8 л С3Н8 взаимодействуют с 224 л О2(по уравнению)
Получили тот же вариант ответа № 4.
Ответ: V(O2) = 10л.