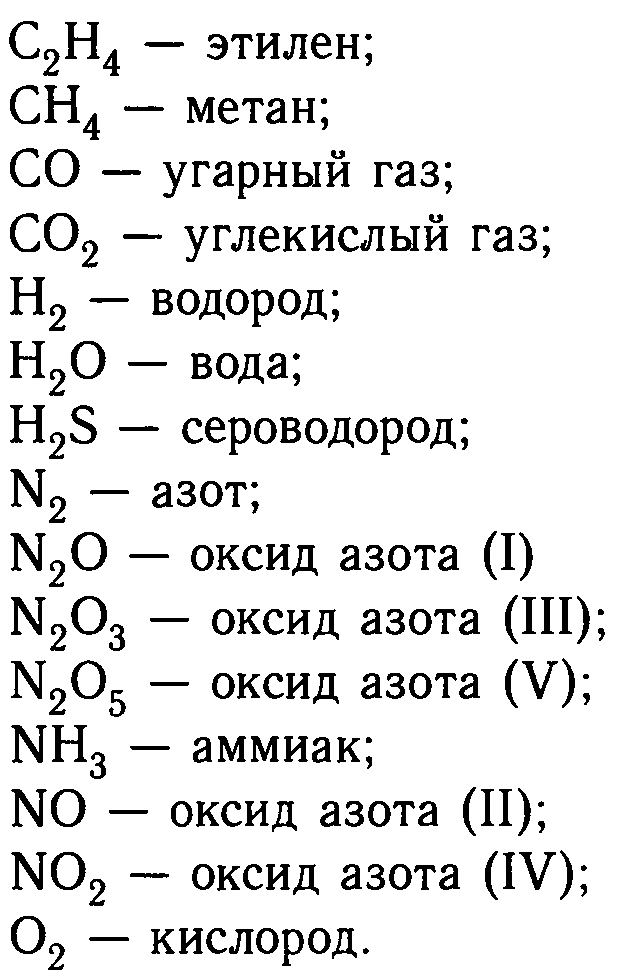
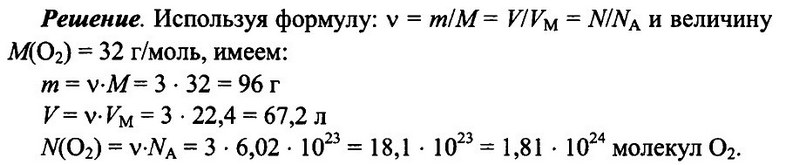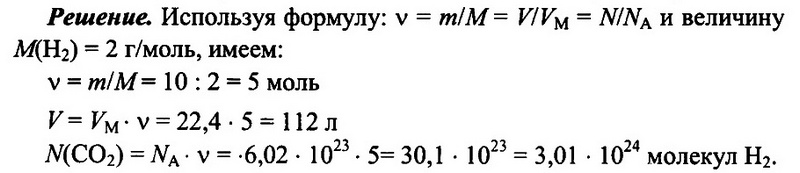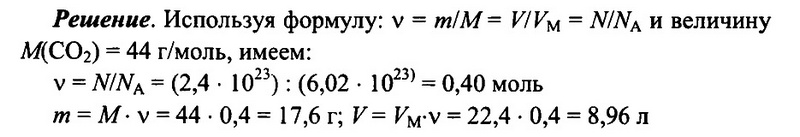Как решать химические задачи
Задача 1
При сгорании органического вещества массой 4,8 г образовалось 3,36 л. CO2 (н.у.) и 5,4 г воды. Плотность паров органического вещества по водороду равна 16. Определите молекулярную формулу исследуемого вещества.
Продукты сгорания вещества состоят из трех элементов: углерода, водорода, кислорода. При этом очевидно, что в состав этого соединения входил весь углерод, содержащийся в CO2, и весь водород, перешедший в воду. А вот кислород мог присоединиться во время горения из воздуха, а мог и частично содержаться в самом веществе. Для определения простейшей формулы соединения нам необходимо знать его элементный состав. Найдем количество продуктов реакции (в моль):
n(CO2) = V(CO2) / VM = 3,36 л : 22,4 л/моль = 0,15 моль
n(H2O) = m(H2O) / M(H2O) = 5,4 г : 18 г/моль = 0,3 моль
Следовательно, в состав исходного соединения входило 0,15 моль атомов углерода и 0,6 моль атомов водорода: n(H) = 2n(H2O), так как в одной молекуле воды содержатся два атома водорода. Вычислим их массы по формуле:
m(H) = 0,6 моль х 1 г/моль = 0,6 г
m(С) = 0,15 моль х 12 г/моль = 1,8 г
Определим, входил ли кислород в состав исходного вещества:
Найдем число моль атомов кислорода:
n(O) = m(O) / M(O) = 2,4 г : 16 г/моль = 0,15 моль
Соотношение числа атомов в молекуле исходного органического соединения пропорционально их мольным долям:
n(CO2) : n(H) : n(O) = 0,15 : 0,6 : 0,15 = 1 : 4 : 1
Самую маленькую из этих величин (0,15) принимаем за 1, а остальные делим на нее.
Итак, простейшая формула исходного вещества CH4O. Однако по условию задачи требуется определить молекулярную формулу, которая в общем виде такова: (CH4O)х. Найдем значение x. Для этого сравним молярные массы исходного вещества и его простейшей формулы:
Зная относительную плотность исходного вещества по водороду, найдем молярную массу вещества:
M(CH4O)х = M(H2) х D(H2) = 2 г/моль х 16 = 32 г/моль
x = 32 г/моль / 32 г/моль = 1
Есть и второй вариант нахождения x (алгебраический):
12x + 4x + 16x = 32; 32 x = 32; x = 1
Ответ: Формула исходного органического вещества CH4O.
Задача 2
В лабораторной установке из 120 л ацетилена (н.у.) получили 60 г бензола. Найдите практический выход бензола.
Какой объем водорода (н.у.) получится при взаимодействии 2 моль металлического натрия с 96%-ным (по массе) раствором этанола в воде (V = 100 мл, плотность d = 0,8 г/мл).
m(раствора) = V х d = 100 мл х 0,8 г/мл = 80 г
m(C2H5OH) =
Найдем заданное количество этанола в моль:
Поскольку заданное количество натрия составляло 2 моль, натрий в нашей задаче присутствует в избытке. Поэтому объем выделенного водорода будет определяться количеством этанола:
Но это еще не окончательный ответ. Будьте внимательны! Вода, содержащаяся в растворе спирта, тоже реагирует с натрием с выделением водорода.
Найдем массу воды:
Количество натрия, оставшееся неизрасходованным после реакции с этанолом, составит:
Таким образом, и по сравнению с заданным количеством воды (0,178 моль) натрий все равно оказывается в избытке.
Найдем количество и объем водорода, выделившегося по реакции:
Общий объем водорода:
Какой объем воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5 л метана и 15 л ацетилена?
Объем кислорода, который пойдет на сжигание заданного объема метана V1(O2) и ацетилена V2(O2), составит:
Отсюда рассчитаем объем воздуха на сжигание (содержание кислорода в воздухе принимаем равным 21% по объему):
V(воздуха) = V(O2) : 0,21 = 47,5 л : 0,21 = 226 л
Ответ: V(воздуха) = 226 л
Смесь этана и этилена объемом 200 мл (нормальные условия) обесцветила бромную воду массой 25 г. Рассчитайте объемную долю этанола в смеси, если массовая доля брома в бромной воде равна 3,2%.
С бромной водой легко взаимодействует только этилен с образованием 1,2 – дибромэтана:
Определяем массу и количество вещества молекулярного брома, содержащегося в бромной воде:
Смесь бензола с циклогексеном массой 5 г обесцвечивает бромную воду массой 125 г ( массовая доля брома 3,2 %). Определите массу воды, которая образуется при сжигании в кислороде той же смеси массой 20 г.
С бромной водой взаимодействует только один компонент смеси – циклогексен:
Определяем массу и количество вещества брома вступившего в реакцию:
m * (Ц) = 8,2 г и n * (Ц) = 0,1 моль.
Составляем уравнения реакции горения бензола и циклогексена:
n(H2O) = (0,45 + 0,5) = 0,95 моль.
Вычисляем массу полученной воды:
При сжигании углеводорода, количество вещества которого равно 0,1 моль, образовались оксид углерода (IV) объемом 6,72 л (нормальные условия) и вода массой 7,2 г. Определите формулу углеводорода.
Решение:
Вычисляем количество вещества оксида углерода (IV), полученного при горении углеводорода:
Количество вещества углерода, содержащегося в сожженном образце углеводорода, равно
Рассчитываем количество вещества воды, полученной при сжигании углеводорода:
Органическое вещество имеет относительную плотность паров по водороду 46. Образец этого вещества массой 13,8 г сожгли, получив оксид углерода (IV) объемом 23,52 л (нормальные условия) и воду массой 10,8 г. Определите формулу органического вещества, учитывая, что оно является ароматическим.
Вычисляем молярную массу органического вещества (В), используя относительную плотность его паров по водороду:
Мы определили, что образец CxHy, количество вещества которого равно 0,15 моль, содержит 1,05 моль С и 1,2 моль Н.
Вычисляем коэффициенты x и y.
x = n(C)/n(B); x = 1,05/0,15 = 7;
y = n(H)/n(B); y = 1,2/0,15 = 8;
Ответ: Формула ароматического углеводорода С7Н8 или С6Н5 – СН3. Это толуол.
Этанол объемом 30 мл (плотностью 0,79 г/мл) нагрели с избытком бромида натрия и серной кислоты. Из реакционной среды выделили бромэтан массой 42,3 г. Определите массовую долю выхода бромэтана.
При нагревании смеси этанола с бромидом калия и серной кислотой происходят реакции:
Как, исходя из этана, получить этилацетат? Напишите уравнения соответствующих реакций.
Бромированием этана вначале получаем бромэтан:
Проводя гидролиз бромэтана в присутствии щелочи, получаем этанол:
(щелочь необходима для смещения равновесия в сторону спирта).
Из спирта можно получить альдегид двумя путями:
а) дегидрированием спирта
б) окислением спирта
Окисляя альдегид (любым окислителем), можно получить уксусную кислоту:
Формулу одноосновной карбоновой кислоты можно представить в виде CxHyCOOH или Cx+1Hy+1O2. Выбираем для расчетов образец кислоты массой 100 г. Вычисляем массы и количества вещества С, Н и О в этом образце:
Коэффициенты в формуле кислоты будут равны:
Записываем уравнение реакции нейтрализации этой кислоты гидроксидом натрия:
Из условия задачи следует, что для нейтрализации взят образец кислоты массой 12 г, то есть m(CH3COOH) = 12 г.
Определяем количество вещества кислоты:
Какой объем 15%-ного раствора гидроксида калия (плотность 1,14 г/мл) потребуется для нейтрализации аминоуксусной кислоты, полученной из 12,8 г карбида кальция?
Составляем уравнения реакции синтеза аминоуксусной кислоты из карбида кальция:
а) получение ацетилена из карбида кальция
б) получение ацетальдегида (реакция Кучерова)
в) окисление ацетальдегида любым окислителем
г) хлорирование уксусной кислоты
д) взаимодействие хлоруксусной кислоты с аммиаком
Определяем количество вещества карбида кальция CaC2:
Как можно получить анилин, исходя из метана и не используя другие органические соединения. Укажите условия протекания реакций.
Проводя пиролиз метана, можно получить ацетилен:
В присутствии угольного катализатора из ацетилена можно получить бензол:
Под действием нитрирующей смеси ( смесь концентрированных азотной и серной кислот) на бензол образуется нитробензол:
Определите молярную массу (г\моль) алкана, содержащего 16 атомов водорода. Составьте структурную формулу. Назовите вещество
1) Запишем общую формулу гомологического ряда алканов: СnН2n+2
2) Запишем формулу алкана с 16 атомами водорода:
Если водорода 16 атомов, то углерода соответственно 7.
4) Составим структурную формулу:
5) Назовем вещество: гептан.
3) Найдем число атомов водорода в молекуле, если n=4.
Атомов водорода соответственно 6.
4) Составим структурную формулу:
5) Назовем вещество:
1 Рассмотрим функциональные особенности веществ:
а ) бутен СН2=СН – СН2– СН3 относится к ненасыщенным углеводородам, содержащим двойную связь.
б ) бутанол СН3— СН 2– СН2– СН2ОН относится к насыщенным одноатомным спиртам.
в) бутановая кислота СН3— СН 2– СН2– СООН относится к насыщенным одноатомным кислотам, содержит карбоксильную группу.
2 Рассмотрим качественные реакции:
а ) Качественной реакцией на алкены является пропускание их через бромную воду или раствор перманганата калия.
б ) Качественной реакцией на насыщенные одноатомные спирты является взаимодействие с металлическим натрием.
в) Качественной реакцией на карбоновые кислоты является изменение окраски индикатора в их среде и взаимодействие их со спиртами.
3 Опишем наблюдения и составим уравнения реакций.
а ) При пропускании бутена через бромную воду происходит обесцвечивание раствора.
б ) При действии на спирты металлического натрия наблюдается выделение газа и образование студенистой массой алкоголята.
в) При добавлении к раствору бутановой кислоты индикатора лакмуса или метилового оранжевого наблюдается красное окрашивание.
При нагревании кислоты со спиртом в присутствии концентрированной серной кислоты появляется «эфирный запах» и образование слоя эфира, не смешивающегося с водой.
СН3— СН 2– СН2– СООН + С2Н5ОН = СН3— СН 2– СН2– СОО С2Н5 + Н2О.
Органическое вещество содержит углерод(массовая доля 84,21%) и водород (15,79%).Плотность паров вещества по воздуху составляет 3,93. Определите формулу этого вещества.
Решение :
W(С)= 84,21%.| 1 Пусть масса вещества 100г.
W(Н)= 15,79%.| 2 Тогда m(С)=84,21г, m(Н)=15,79г.
D(возд) = 3,93.| 3 Найдем соотношение количеств веществ:
____________|_υ(С): υ(Н)=84,21\12 :15,79/1=7,0175:15,79=1:2,25=4:9.
Найдем молярную массу простейшей формулы:
Найдем молярную массу истиной формулы:
Найдем соотношение истиной и простейшей молярных масс:
Задача 18
Сколько граммов пропанола-2 с выходом 80% от теоретически возможного получится из 200г пропилена.
1 Составим уравнение реакции получения пропанола-2.
2 Найдем количество вещества пропена, вступившего в реакцию:
4 Найдем массу теоретическую образовавшегося пропанола-2
m = υ*М;
m = 4,76*60=285,7г
5 Учитывая, что выход вещества составляет 80%, найдем массу практическую продукта.
1 Составим уравнение реакции получения метана:
2 Найдем количество вещества ацетата натрия, вступившего в реакцию:
3 Найдем по уравнению, что количество вещества метана равно количеству вещества ацетата натрия, вступившего в реакцию.
4 Найдем объем метана, образовавшегося в результате реакции:
1 Составим уравнение реакции получения ацетилена:
2 Найдем массу чистого карбида кальция:
3 Найдем количество вещества карбида кальция, вступившего в реакцию:
4 Найдем по уравнению, что количество вещества ацетилена равно количеству вещества карбида кальция, вступившего в реакцию:
5 Найдем объем ацетилена, образовавшегося в результате реакции:
1 Составим уравнение реакции
2 Найдем количество вещества уксусной кислоты, вступившей в реакцию:
3 Найдем по уравнению, что количество вещества этилацетата равно количеству вещества уксусной кислоты, вступившей в реакцию:
4 Найдем теоретическую массу образовавшегося этилацетата
5 Учитывая, что масса практическая этилацетата 400г, найдем массовую долю выхода продукта:
1 Составим уравнение реакции получения ацетилена:
2 Найдем количество вещества ацетилена, образовавшегося в результате реакции:
3 Найдем по уравнению, что количество вещества карбида кальция равно количеству вещества ацетилена, образовавшегося в результате реакции:
4 Найдем массу чистого карбида кальция:
5 Найдем массу примесей:
6 Найдем массовую примесей в карбиде:
1 Составим уравнение реакции
2 Найдем теоретическую массу образовавшегося продукта:
3 Найдем количество вещества диэтилового эфира, образовавшегося в результате реакции:
5 Найдем массу этанола, вступившего в реакцию:
m = υ*М;
m =6,76*46=310,8г
Задача 24
Сколько грамм 8% раствора уксусной кислоты необходимо для получения водорода объемом 2,8л при взаимодействии ее с магнием.
1 Составим уравнение реакции
2 Найдем количество вещества водорода, образовавшегося в результате реакции :
3 Найдем по уравнению, что количество вещества водорода в 2 раза меньше количеств вещества уксусной кислоты, вступившей в реакцию:
4 Найдем массу уксусной кислоты:
5 Найдем массу раствора уксусной кислоты:
Сколько граммов этилацетата можно получить при взаимодействии 100г уксусной кислоты с 50г этанола.
1 Составим уравнение реакции
2 Найдем количество веществ уксусной кислоты и этанола, вступившей в реакцию:
3 Так как по уравнению реакции уксусная кислота и этанол реагирует 1:1, то из найденных значений видно, что в избытке находится уксусная кислота и часть ее останется после реакции, а этанол прореагирует полностью. Решаем по недостатку.
4 Найдем по уравнению, что количество вещества этанола равно количеству вещества этилацетата, образовавшегося в результате реакции:
5 Найдем массу этилацетата:
m = υ*М;
m = 1,09*88=95,7г ответ : 95,7г
Как решать химические задачи
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
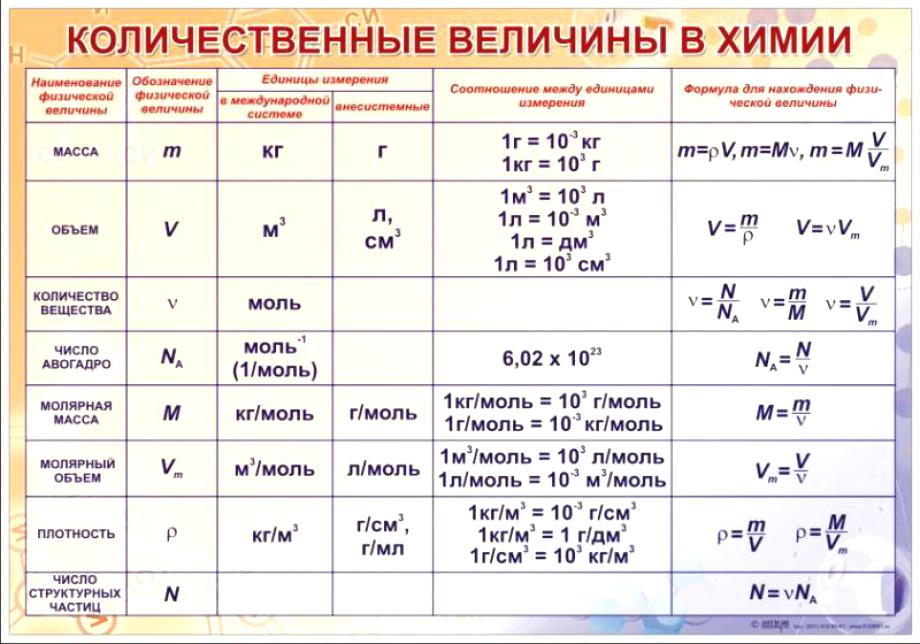
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м 3 /кмоль) при н.у.,
Na = 6,02 • 10 23 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1. Какое количество вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(СО2) = 0,75 моль.
Задача № 2. Какое число молекул содержится в 2,5 моль кислорода?
Задача № 3. Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4. Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5. Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Задача № 6. Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Задача № 7. Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Задача № 8. Имеется 2,4 • 10 23 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9. Какова масса порции оксида азота (IV), содержащей 4,816 • 10 23 молекул? Каков ее объем (н. у.)?
Задача № 10. Масса порции простого вещества, содержащей 1,806 • 10 24 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
Как научиться решать задачи по химии
Решение задач по химии имеет свою специфику, и нужно найти отправную точку, которая поможет научиться разбираться в этом нелегком деле.
Что необходимо знать для решения задач по химии
Чтобы правильно решать задачи по химии, в первую очередь необходимо знать, что такое валентность элементов. От этого зависит составление формулы вещества, уравнение химической реакции также без учета валентности не составить и не уравнять. Таблица Менделеева используется практически в каждом задании, нужно научиться ею правильно пользоваться, чтобы получать необходимые сведения о химических элементах, их массе, электронным уровням. Чаще всего в задачах требуется вычислить массу либо объем получаемого в итоге продукта, это – основа.
Если валентность определить неправильно, все расчеты окажутся неверными.
И далее другие, более сложные задачи, будут решаться легче. Но прежде всего – формулы веществ и правильно составленные уравнения протекающих реакций, с указанием того, что в итоге получится, и в каком виде. Это может быть жидкость, свободно выделяющийся газ, твердое вещество, выпадающее в осадок либо растворенное в воде или иной жидкости.
С чего начинать при решении задач по химии
Для решения задачи кратко записывается ее условие. После этого составляется уравнение реакции. Для примера можно рассмотреть конкретные данные: нужно определить массу полученного вещества, сульфида алюминия, при реакции металлического алюминия с серной кислотой, если алюминия взято 2,7 грамма. Обращать внимание следует лишь на вещества, что известны, после – на те, что требуется найти.
Начинать решать нужно с перевода массы в граммах в молярную. Составить формулу реакции, подставить в нее значения массы и рассчитать пропорцию. После того, как решена простая задача, можно попробовать освоить самостоятельно аналогичную, но с другими элементами, что называется, набить руку. Формулы будут такими же, только элементы изменятся. Все решение задач по химии сводится к написанию правильной формулы вещества, далее – к правильному составлению уравнения реакции.
Все задачи решаются по одному принципу, главное, правильно расставить коэффициенты в уравнении.
Новости
Формулы для решения задач по химии
Так как химия наука точная, она неразрывно связана с различного рода вычислениями. Чтобы решать задачи, нужно знать формулы и хорошо в них ориентироваться. Без этих базовых знаний и навыков изучение химии становится невозможным.
Мы собрали для вас основные химические формулы, изучаемые в школьном курсе. Они пригодятся каждому ученику, особенно тем, кто будет сдавать ОГЭ или ЕГЭ по этому непростому, но очень интересному предмету.
Нахождение количества вещества
Первое и основное понятие, которое необходимо усвоить – это количество вещества, измеряемое в молях и обозначающееся латинской буквой «n». Для его нахождения нужно основываться на условии задачи, так как вычислить количество вещества можно по трём формулам:
1) По массе. n=m/M — Массу вещества (в граммах) разделить на его молярную массу (в г/моль).
2) По объёму. n=V/Vm — Отношением объёма вещества к его молярному объёму (используется для газов).
Формулы для нахождения массы
Массу вещества можно найти несколькими способами:
1. Умножив количество вещества на молярную массу: m (г) = n (моль)×M (г/моль).
2. Произведением объёма раствора и его плотности: m = V (л) ×ρ (г/л).
3. Перемножив массовую долю с массой раствора: m = m(р-ра) × ω.
Молярная масса (М) – это масса одного моля вещества. Вычисляется она следующим образом: посредством сложения атомных масс элементов, из которых состоит вещество, получаем относительную молекулярную массу. Молярная масса численно равна относительной молекулярной массе, но имеет размерность «г/моль». Также молярную массу можно найти с помощью отношения массы вещества к его количеству:
Формулы для нахождения объёма
Для вычисления объёма того или иного вещества можно воспользоваться одной из формул:
1. Объём раствора находится как отношение массы раствора к его плотности:
2. Объём газа равен отношению его количества вещества к молярному объёму:
Молярный объём (VM) – объём, который занимает 1 моль вещества при определённых показателях давления и температуры. Находится при делении молярной массы вещества на его плотность:
При нормальных условиях молярный объём газа равен 22,4 л/моль.
Формулы для нахождения плотности и относительной плотности
Плотность (ρ) – физическая величина, указывающая на массу определённого вещества, содержащуюся в единице объёма.
Следовательно, формула для её вычисления имеет вид:
Помимо основной, существует формула для нахождения плотности газа при нормальных условиях, где молярная масса делится на молярный объём газа при н.у.:
Относительная плотность (D) газов – величина, указывающая насколько одно вещество тяжелее или легче другого. Вычисляется она отношением молярных масс газов:
Например, условием было найти плотность газа по водороду. Решение будет иметь вид: D = M(газа)/M(H2) = M(газа)/2. Относительная плотность является безразмерной величиной.
Формулы для нахождения концентрации
Молярная концентрация (С) – отношение количества растворённого вещества к объёму раствора. Единица измерения – моль/л. Молярная концентрация вычисляется по формуле:
Массовая концентрация чаще всего называется титром (Т). Это отношение массы растворённого вещества к объёму раствора. Единица измерения — г/л.
Массовая доля (ω) – это один из вариантов выражения концентрации. С её помощью можно вычислить процентное содержание растворённого вещества в общей массе раствора:
По такому же принципу вычисляется массовая доля определённого компонента в смеси:
Если возникает необходимость найти массовую долю химического элемента в соединении, то нужно относительную атомную массу этого элемента умножить на число атомов в соединении и разделить на молекулярную массу вещества:
Формулы для нахождения выхода продукта реакции
Попрактиковать решение задач и знание формул возможно в приложении «ХиШник». Оно содержит в себе каталог заданий, которые, в свою очередь, разделены по темам и уровням сложности. Если вы дали неверный ответ, то приложение не просто уведомит об этом, а предложит правильный алгоритм решения. Также в нём есть раздел для подготовки к ОГЭ и ЕГЭ, в котором собраны типовые задания.
Знание расчётных формул – это ключевой момент при решении задач. Главное, понимать их, а не бездумно заучивать. Так как они будут использоваться не только в школьных задачах, на ЕГЭ и ОГЭ, но и в дальнейшей жизни, даже если ваша профессиональная сфера будет далека от химии.
Еще по этой теме:
Серная кислота
Основные сведения о серной кислоте: свойства, получение, применение.
Теперь «ХиШник» стал полностью бесплатным
Как развивалось приложение все эти годы, и почему мы им так гордимся.
Азотная кислота
Статья содержит основную информацию об азотной кислоте: её свойства, получение и применение.
Диены
Основные сведения о диеновых углеводородах: номенклатура и изомерия, классификация, химические свойства, получение.
Правило Марковникова
Правило Марковникова: формулировка, механизм протекания реакций, исключения из правила.
Таблицы для ЕГЭ по химии
В статье представлены таблицы, необходимые при изучении химии и сдаче ЕГЭ.
Внеклассное мероприятие по химии
Идеи интересных внеклассных мероприятий по химии.
Химические профессии
Обзор необычных профессий, связанных с химией.
ЕГЭ по химии 2019
Основная информация о ЕГЭ по химии 2019: структура экзамена, баллы, даты проведения.
Критерии оценивания ОГЭ по химии, баллы 2019
Подробно расскажем о баллах ОГЭ по химии 2019, методах и критериях оценивания заданий и переводе первичных баллов в школьную оценку.
Изменения ОГЭ по химии в 2019 году
Расскажем об изменениях, которые ждут школьников при сдаче ОГЭ по химии в 2019 году.
Подготовка к ОГЭ по химии
Несколько советов и рекомендаций, следуя которым подготовка к ОГЭ по химии будет проходить результативно.
Онлайн тесты по химии
Немного информации о проверке знаний с помощью тестов по химии в режиме онлайн.
Все об ОГЭ по химии в 2019
Основные сведения об ОГЭ по химии 2019: даты, время, баллы, материалы для подготовки.
Тест по химии 11 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 11 классе.
Тест по химии 10 класс
Общие сведения о тестах по химии в 10 классе.
Тест по химии 9 класс
Рассказываем о тестах по химии, используемых для проверки знаний в 9 классе.
Тест по химии 8 класс
Рассказываем в общих чертах о тестах по химии в 8 классе
Ионная связь
Статья, содержащая в себе базовые понятие об ионном виде химической связи.
Водородная связь
Статья о водородном типе химической связи и его особенностях.
Подготовка к ЕГЭ по химии с нуля
В статье дано несколько действенных советов по подготовке к ЕГЭ по химии «с нуля».
Металлическая связь
Продолжаем серию статей про виды химической связи.
Ковалентная связь
Начинаем серию статей про виды химической связи.
Шкала перевода баллов ЕГЭ по химии 2018
Отвечаем на вопросы о системе оценивания и переводе первичных баллов в тестовые.
Учимся на летних каникулах
Размышляем о том, как полезно провести время во время летнего отдыха на каникулах. (в статье есть подарок внимательным читателям)
«ХиШник» приехал на Сахалин!
Этим летом открывается очередная летняя сессия областной профильной школы для одаренных детей «Эврика».
Мой сын увлёкся химией, что делать?
Собрали ТОП-5 полезных материалов для старшеклассника.
Двенадцать сервисов для изучения химии, с которыми ты точно сдашь
Великолепная подборка полезных сайтов для самостоятельного изучения химии.
О правах и обязанностях в школе: почему необходимо сотрудничество учеников и учителей
Что такое право само по себе и откуда оно берется. Как не заработать славу скандалистов, «вечно качающих права», и при этом не переносить безропотно нарушение своих личных границ…
Современный задачник по химии
материал о том, какие виды задачников по химии существуют и как среди них ориентироваться.
Выбираем репетитора по химии: инструкция
Научиться решать задачи по химии легко: следуем инструкции
Учимся решать задачи по химии к ОГЭ, ЕГЭ, инструкция от ХиШника
Изменения в ЕГЭ по химии 2018 года, новая демоверсия, спецификация, кодификаторы ЕГЭ
ФИПИ снова решил усложнить нам жизнь новыми требованиями к ЕГЭ. О том, почему изменения не всегда плохи, и как встретить их с достоинством.
Обновление в демонстрационной версии «ХиШника»
Мы расширили приветственное окно, чтобы при входе в приложение всем новым пользователям были понятны основные принципы работы «ХиШника».
Активация лицензионного ключа и первые шаги в «ХиШнике».
Что такое лицензионный ключ и как происходит его активация в приложении
Современный урок химии по ФГОС
Для чего нужны стандарты, по которым происходит обучение химии в российских школах, и как приложение “ХиШник” поможет соответствовать этим стандартам?
ХиШник в школе: ИКТ на уроках химии
Как наше приложение поможет внедрить ИКТ в уроки
Ура! Новые планы ХиШника и подарочки
Подводим итоги 2017, планируем 2018 и, конечно же, дарим подарки!
Родина приложения «ХиШник» – Новосибирский Академгородок
Почему же родиной «ХиШника» стал Новосибирский Академгородок?
Совпадение не случайное.
Можно ли просматривать историю решения задач учениками в онлайн-режиме?
Итак, «ХиШник» это приложение, в котором могут работать и ученики, и преподаватели. После того, как преподаватель создает в приложении учебную группу
Можно ли заниматься в «ХиШнике» со смартфона/планшета?
Сегодня у нас вопрос, которого мы давно ждали: можно ли заниматься в «ХиШнике» со смартфона/планшета?
Семинар от «ХиШника» на КПК для учителей химии
На прошлой неделе мы провели семинар в рамках масштабных ежегодных курсов повышения квалификации на базе СУНЦ НГУ (Новосибирск, Академгородок).
Команда «ХиШника» провела мастер-класс для преподавателей химии и методистов
Вчера команда «ХиШника» провела мастер-класс для преподавателей химии и методистов программ повышения квалификации из разных регионов России.
Как купить полный доступ к приложению?
Сегодня новый вопрос: что делать, если решать задачи в демо-версии приложения понравилось, как получить полный доступ? Отвечаем!
«ХиШник» представляет два кейса на ярмарке кейсов «Школа реальных дел»
Ярмарка кейсов «Школы реальных дел» – уже в эту пятницу! В этом году «ХиШник» представляет два кейса.
Служба поддержки:
support@hishnik-school.ru
Для СМИ:
onp@alekta.ru
Спасибо!
Настоящее пользовательское (лицензионное) соглашение (далее – «Соглашение») заключается между Обществом с ограниченной ответственностью «АЛЕКТА» (далее – «Лицензиар»), и Пользователем (физическим лицом, выступающем в роли конечного потребителя Продукта) совместно именуемые «Стороны».
Пожалуйста, внимательно ознакомьтесь с текстом настоящего Соглашения. Оно представляет собой публичную оферту и, после его принятия Вами, образует соглашение между Вами (Пользователем) и Лицензиаром о предмете и на условиях, изложенных в тексте Соглашения.
Принимая настоящее Соглашение, Вы соглашаетесь с положениями, принципами, а также соответствующими условиями лицензионного соглашения, изложенными ниже.