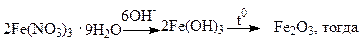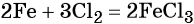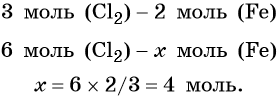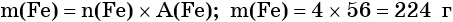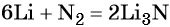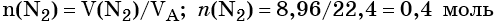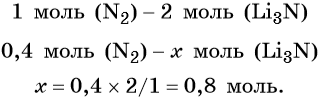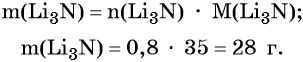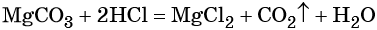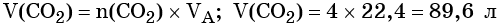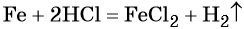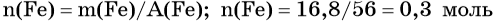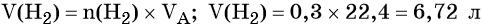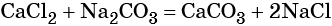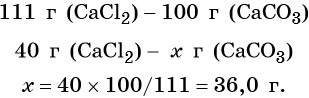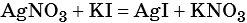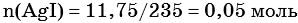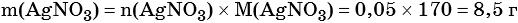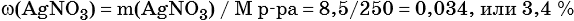Как рассчитывать массу осадка
4.3.6. Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Для расчета массы (объема, количества вещества) продукта реакции, если данные по одному из веществ представлены в виде раствора с определенной массовой долей этого растворенного вещества, следует воспользоваться нижеследующим алгоритмом:
1) Прежде всего следует найти массу растворенного вещества. Возможны две ситуации:
* В условии даны масса раствора и массовая доля растворенного вещества (концентрация). В этом случае масса растворенного вещества рассчитывается по формуле:
* В условии даны объем раствора вещества, плотность этого раствора и массовая доля растворенного вещества в этом растворе. В таком случае следует воспользоваться формулой для расчета массы раствора:
После чего следует рассчитать массу растворенного вещества по формуле 1.
2) Рассчитать количество вещества (моль) участника реакции, масса которого стала известна из расчетов выше. Для этого воспользоваться формулой:
3) Записать уравнение реакции и убедиться в правильности расставленных коэффициентов.
4) Рассчитать количество моль интересующего участника реакции исходя из известного количества другого участника реакции, зная, что количества веществ любых двух участников реакции A и B относятся друг к другу как коэффициенты перед этими же веществами в уравнении реакции, то есть:
Если в условии требовалось рассчитать количество вещества, то действия на этом заканчиваются. Если же требуется найти его массу или объем, следует переходить к следующему пункту.
5) Зная количество вещества, определенное в п.4, мы можем рассчитать его массу по формуле:
Также, если вещество является газообразным и речь идет о нормальных условиях (н.у.), его объем может быть рассчитан по формуле:
Рассмотрим пару примеров расчетных задач по этой теме.
Пример 1
Рассчитайте массу осадка, который образуется при добавлении к 147 г 20%-ного раствора серной кислоты избытка раствора нитрата бария.
Решение:
1) Рассчитаем массу чистой серной кислоты:
2) Рассчитаем количество вещества (моль) серной кислоты:
3) Запишем уравнение взаимодействия серной кислоты с нитратом бария:
4) В результате расчетов стало известно количество вещества серной кислоты. Осадок представляет собой сульфат бария. Зная, что:
n(BaSO4)/n(H2SO4) = k(BaSO4)/k(H2SO4), где n — количество вещества, а k — коэффициент в уравнении реакции,
5) Тогда масса осадка, т.е. сульфата бария, может быть рассчитана следующим образом:
m(BaSO4) = M(BaSO4) ∙ n(BaSO4) = 233 г/моль ∙ 0,3 моль = 69,9 г
Пример 2
Какой объем газа (н.у.) выделится при растворении необходимого количества сульфида железа (II) в 20%-ном растворе соляной кислоты с плотностью 1,1 г/мл и объемом 83 мл.
Решение:
1) Рассчитаем массу раствора соляной кислоты:
m(р-ра HCl) = V(р-ра HCl) ∙ ρ(р-ра HCl) = 83 мл ∙ 1,1 г/мл = 91,3 г
Далее рассчитаем массу чистого хлороводорода, входящего в состав кислоты:
m(HCl) = m(р-ра HCl) ∙ w(HCl)/100% = 91,3 г ∙ 20%/100% = 18,26 г
2) Рассчитаем количество вещества хлороводорода:
n(HCl) = m(HCl)/M(HCl) = 18,26 г/36,5 г/моль = 0,5 моль;
3) Запишем уравнение реакции сульфида железа (II) с соляной кислотой:
4) Исходя из уравнения реакции следует, что количество прореагировавшей соляной кислоты с количеством выделившегося сероводорода связано соотношением:
n(HCl)/n(H2S) = 2/1, где 2 и 1 — коэффициенты перед HCl и и H2S соответственно
n(H2S) = n(HCl)/2 = 0,5/2 = 0,25 моль
5) Объем любого газа, находящегося при нормальных условиях, можно рассчитать по формуле V(газа) = Vm ∙ n(газа), тогда:
V(H2S) = Vm ∙ n(H2S) = 22,4 л/моль ∙ 0,25 моль = 5,6 л
Как найти массу осадка
Часто бывает так, что в ходе химической реакции образуется малорастворимое вещество, выпадающее в осадок (к примеру, сульфат бария, фосфат кальция, хлорид серебра и т.д.). Предположим, химику поставлена задача: определить массу этого осадка. Каким образом можно это сделать?
Если вам неизвестны точные количества исходных веществ, то придется действовать опытным путем. То есть сначала отделите осадок от раствора (путем фильтрования или на обычной воронке, или с использованием воронки Бюхнера). После чего тщательно высушите его и взвесьте на аналитических весах. Так вы получите достаточно точный результат.
Ну а если вам известны точные количества веществ, вступавших в реакцию, то все будет гораздо проще. Например, изначально было 28,4 грамма сульфата натрия и 20,8 грамма хлорида бария. Сколько граммовобразовалось?
Напишите правильное уравнение химической реакции: Na2SO4 + BaCl2 = BaSO4 + 2NaCl.В результате этой реакции образуется практически нерастворимое вещество – сульфат бария, мгновенно выпадающий в виде плотного белого осадка.
Вычислите, какое из веществ было взято в недостатке, а какое – в избытке. Для этого подсчитайте молярные массы исходных реагентов:46 + 32 + 64 = 142 г/моль – молярная масса сульфата натрия;
137 + 71 = 208 г/моль – молярная масса хлорида бария.То есть в реакцию вступали 0,2 моля сульфата натрия и 0,1 моля хлорида бария. Сульфат натрия был взят в избытке, следовательно, весь хлорид бария прореагировал.
Подсчитайте количество образовавшегося осадка. Для этого разделите молекулярную массу сульфата бария на молекулярную массу хлорида бария и результат умножьте на количество исходного вещества:20,8 * 233/208 = 23,3 грамма.
А если бы сульфат натрия был в недостатке? Предположим, в реакцию вступило бы не 28,4 грамма этой соли, а в 5 раз меньше – всего 5,68 грамма. И тут нет абсолютно ничего сложного. 5,68 грамма сульфата натрия составляют 0,04 моля. Следовательно, в реакцию с таким количеством этой соли могло вступить также всего 0,04 моля хлорида бария, то есть 0,04 х 208 = 8,32 грамма. Прореагировало только 8,32 грамма из исходных 20,8 граммов.
Умножив эту величину на соотношение молярных масс сульфата бария и хлорида бария, получите ответ: 8,32 * 233/208 = 9,32 грамма осадка.
Лекция 35. Расчёт навески. Выбор и расчет осадителя
Ключевые слова: осаждаемая форма, выбор осадителя, расчёт навески и объёма осадителя.
Расчёт и взятие навески анализируемого образца. Допустимая ошибка гравиметрических определений не должна превышать 0,1%. Абсолютная погрешность взвешивания на аналитических весах составляет ± 0,0001 г. С увеличением массы навески относительная погрешность взвешивания уменьшается: отн. погр. = (0,0001/mнавески). Минимальная навеска (с относительной погрешностью ± 0,1%) рассчитывается следующим образом: mнавески = (0,0001г ·100%)/0.1% = 0,1 г. То есть минимальная навеска, которую следует взвешивать на аналитических весах, должна быть не меньше 0,1 г.
При выборе навески анализируемого образца исходят из практической целесообразности и удобства работы с осадками. При расчете навески образца следует учитывать, какую структуру имеет осаждаемая форма. Особенно трудоемкой является обработка аморфных осадков. Поэтому для них навеску рассчитывают исходя из минимального необходимого количества получаемой весовой формы: mосадка ≈ 0,1 г. В зависимости от структуры осадка масса весовой формы может колебаться в следующих интервалах:
кристаллический, легкий (СаСО3) 0,1—0,15 г
кристаллический, тяжелый (BaSО4) 0,2—0,4 г
кристаллический, очень тяжелый (PbSО4) до 0,5 г
Масса кристаллического осадка не должна превышать 0,5 г. Это обеспечивает удобство работы при фильтровании и промывании осадков. Эти примерные критерии служат основанием для оценки массы пробы (навески), необходимой для анализа. Расчёт навески анализируемого вещества осуществляют по уравнению реакции, составляя пропорцию или осуществляя расчет через количество вещества (моль) и молярные массы. Например, при определении бария в хлориде бария навеску вычисляют по уравнению реакции.
Поскольку из 1 моль BaCl2·2H2O образуется 1 моль BaSO4, можно составить пропорцию:
Можно рассчитывать массу навески образца через количества веществ. По уравнению реакции: n(BaCl2·2H2O) = n(BaSO4) = m(BaSO4)/M(BaSO4);
Так как молярная масса хлорида и сульфата бария близкие по величине, расчетная масса навески равна примерно 0,5 г. Учитывая содержание примесей в анализируемом образце, масса навески может быть увеличена до 1 г.
Для аморфных осадков рекомендуемая масса весовой формы равна 0,1г. Например, для анализа содержания железа в нитрате железа (III) проводят цепочку реакций по схеме, в соответствии с которой необходимо учесть соответствующие стехиометрические коэффициенты:
Навеску на аналитических весах взвешивают в специальных чистых и сухих стаканчиках – бюксах. Взятие навески можно провести двумя способами.
1-й способ взятия навески. Предварительно на технических, а затем аналитических весах определяют массу пустого бюкса (mпустого бюкса). Затем в бюкс насыпают примерное близкое к рассчитанному количество навески и взвешивают бюкс с навеской сначала на технических, а затем на аналитических весах (m бюкса с навеской). Точную массу навески определяют по разности:
Взвешенную навеску переносят количественно (без потерь) в химический стакан для приготовления раствора пробы, бюкс тщательно промывают несколько раз небольшими порциями воды (растворителя).
2-й способ взятия навески. Предварительно на технических весах определяют массу пустого бюкса. Затем в бюкс насыпают примерное близкое к рассчитанному количество навески и взвешивают бюкс с навеской сначала на технических, а затем на аналитических весах (m бюкса с навеской). Навеску переносят количественно (без потерь) в химический стакан, бюкс с остатками пробы взвешивают на аналитических весах (m пустого бюкса с остатками). В этом случае бюкс не промывают. Точную массу навески определяют по разности:
К осаждаемой форме предъявляются следующие требования:
— по возможности иметь кристаллическую структуру, так как кристаллические осадки меньше загрязняются и легче обрабатываются (промываются, фильтруются);
— легко превращаться в весовую форму при прокаливании.
Эти требования определяют выбор осадителя. Он должен осаждать количественно определяемый компонент в труднорастворимый осадок и быть летучим веществом, чтобы не загрязнять осадок после прокаливания. Например, при определении ионов бария в хлориде бария в качестве осадителя выбирают раствор серной кислоты, а не растворимую соль – сульфат натрия, потому что во время прокаливания (
Расчёт необходимого количества осадителя проводят по уравнению реакции, аналогично описанному выше расчету массы навески анализируемого образца. Рассмотрим на примере определения ионов бария и произведем расчёт по уравнению реакции:
1 моль BaCl2·2H2O взаимодействует с 1 моль H2SO4, составляем пропорцию:
Для осаждения необходимо использовать очень разбавленные растворы осадителя. Их готовят разбавлением более концентрированных растворов. Рассчитаем необходимый объем 2 н. (1М) раствора серной кислоты. Если концентрация раствора серной кислоты равна 1 моль/л, в 1000 мл раствора содержится один моль кислоты, то есть 98 г. Составим пропорцию:
В 1000 мл 2 н. раствора
Для количественного полного осаждения объём осадителя, следует брать в полтора раза больше рассчитанного:
Контрольные вопросы
1. Как рассчитать минимальную массу навески?
2. Какие требования предъявляются к осаждаемой форме?
3. Как выбрать осадитель и рассчитать объём раствора осадителя?
Список рекомендуемой литературы
Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.