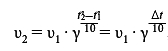Как рассчитать теплоту химия
КАК ВЫЧИСЛИТЬ ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ И СОСТАВИТЬ ЕЕ ТЕРМОХИМИЧЕСКОЕ УРАВНЕНИЕ
Вычислить тепловой эффект реакции важно для того, чтобы правильно организовать многие процессы на промышленных производствах. Это необходимо там, где используется подача энергии или где, наоборот, требуется ее отведение. Поскольку одни виды энергии могут превращаться в другие, то применение теплового эффекта химического взаимодействия позволяет превратить внутреннюю энергию веществ в работу (механическую, электрическую и т.д.).
С выделением или поглощением тепла идут процессы в живых организмах. Точный расчет тепловых эффектов превращения белков, жиров, углеводов и других веществ позволяет организовать правильную диету спортсменам, людям с теми или иными заболеваниями.
Содержание:
Что такое тепловой эффект химической реакции
Химические реакции практически всегда сопровождаются какими-либо тепловыми явлениями.
Так, горение, нейтрализация кислоты щелочью, реакция металла (например, магния) с хлором и т.д. происходят с выделением достаточного количества тепла. А вот, чтобы разложить мел (карбонат кальция), необходимо все время его нагревать. Если нагревание (то есть подвод тепла) прекратить, то и реакция тоже прекратится. Это говорит о том, что разложение карбоната кальция идет с поглощением тепла.
В чем же дело? Любое вещество является продуктом взаимодействия частиц (атомов или ионов). В ходе образования вещества энергия взаимодействия как бы прячется в химических связях (ковалентных, ионных). Это так называемая внутренняя энергия, которая частично высвобождается в ходе химического взаимодействия. Она же – тепловой эффект реакции. Измеряя его, можно судить о том, как изменилась внутренняя энергия вещества.
Тепловой эффект химической реакции обозначают буквой Q и измеряют в кДж (или в ккал в случае, когда речь идет об обеспечении энергией живых организмов).
Как вычислить тепловой эффект реакции и
составить термохимическое уравнение
Например, обычное уравнение реакции:
А это уже термохимическое уравнение данной реакции:
Уравнение говорит о том, что при взаимодействии 1 моля PbO с 1 молем СО, идущем с образованием 1 моля Pb и 1 моля CO2, выделяется 64 кДж теплоты.
Особенности термохимических уравнений:
1) указывается агрегатное состояние веществ (однако, если все вещества находятся в одном агрегатном состоянии, то его могут не указывать);
2) указывается тепловой эффект реакции в соответствии с ее стехиометрией (то есть, в соответствии с правильно расставленными коэффициентами);
3) тепловой эффект записывается в левой части уравнения;
4) если речь идет о горении вещества, то уравнение составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции называется теплотой сгорания:
5) если речь идет об образовании вещества, то уравнение также составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции будет называться теплотой образования:
А теперь разберем несколько задач, требованием которых является составление термохимического уравнения.
Что нужно сделать для решения таких задач?
1) записать условие задачи;
2) составить уравнение реакции;
3) вычислить ее тепловой эффект;
4) записать полученное значение теплового эффекта в уравнение реакции.
Пример 1. Кальций массой 8 г сгорает с выделением 127 кДж теплоты. Напишите термохимическое уравнение (тху) реакции.
Пример 2. При разложении 6,86 г оксида ртути (II) тратится 3,64 кДж тепловой энергии. Напишите термохимическое уравнение (тху) реакции.
Пример 3. Реакция 6 г углерода с водородом приводит к выделению 37,42 кДж теплоты. Напишите термохимическое уравнение (тху) реакции образования метана.
Расчеты по термохимическим уравнениям
В термохимических расчетах чаще используются уже готовые термохимические уравнения. Требуется найти массы/объемы образующихся/исходных веществ, количество выделившейся/поглощенной теплоты.
Рассмотрим несколько примеров.
Пример 4. По термохимическому уравнению: N2(г.) + O2(г.) = 2NO(г.) – 180,7 кДж вычислите тепловой эффект реакции, в которой участвует азот объемом 5,6 л (при н.у.).
Поскольку реакция эндотермическая, то поглотится 45,2 кДж энергии.
Пример 5. Тепловой эффект реакции горения этилена составляет 1400 кДж (в расчете на 1 моль этилена). Сколько этилена (при н.у.) необходимо сжечь, чтобы получить 560 кДж теплоты?
Пример 6. Пользуясь термохимическим уравнением сгорания пропана
определите количество выделившейся теплоты, если в реакцию вступит кислород: а) массой 16 г; б) объемом 67,2 л; в) количеством вещества 2,5 моль. Сколько оксида углерода (IV) по объему и по массе получится, если при горении пропана выделится 277,5 кДж теплоты?
Если вы готовитесь к выпускному экзамену ( ЕГЭ по химии ), то имейте ввиду, что вычислить тепловой эффект реакции требует задание № 27 (версия 2022 года ).
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию 
Теплота реакции и термохимические расчёты



Теплотой реакции (тепловым эффектом реакции) называется количество выделенной или поглощённой теплоты Q. Если в ходе реакции теплота выделяется, такая реакция называется экзотермической, если теплота поглощается, реакция называется эндотермической.
Теплота реакции определяется, исходя из первого закона (начала) термодинамики, математическим выражением которого в его наиболее простой форме для химических реакций является уравнение:
Термохимический расчёт заключается в определении теплового эффекта реакции. В соответствии с уравнением (2.1) численное значение теплоты реакции зависит от способа её проведения. В изохорном процессе, проводимом при V=const, теплота реакции QV=ΔU, в изобарном процессе при p=const тепловой эффект QP =ΔH. Таким образом, термохимический расчёт заключаетсяв определении величины изменения или внутренней энергии, или энтальпии в ходе реакции. Поскольку подавляющее большинство реакций протекает в изобарных условиях (например, это все реакции в открытых сосудах. протекающие при атмосферном давлении), при приведении термохимических расчётов практическивсегда производится расчёт ΔН. ЕслиΔН 0, то реакция эндотермическая.
Термохимические расчёты производятся, используя или закон Гесса, согласно которому тепловой эффект процесса не зависит от его пути, а определяется лишь природой и состоянием исходных веществ и продуктов процесса, или,чаще всего, следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпий ) образования продуктов за вычетом суммы теплот ( энтальпий ) образования реагентов.
В расчётах по закону Гесса используются уравнения вспомогательных реакций, тепловые эффекты которых известны. Суть операций при расчётах по закону Гесса заключается в том, что над уравнениями вспомогательных реакций производят такие алгебраические действия, которые приводят к уравнению реакции с неизвестным тепловым эффектом.
Если в термохимическом расчёте используется следствие из закона Гесса, то для реакции, выраженной уравнением aA+bB=cC+dD, пользуются соотношением:
В термохимических расчётах теплоты реакций, как правило, определяются для стандартных условий, для которых формула (2.2) приобретает вид:
Пример 2.2. Расчёт стандартной теплоты реакции, выраженной уравнением:
Согласно следствию из закона Гесса записываем 3* :
Отрицательный знак теплоты реакции указывает на экзотермичность процесса.
В термохимии тепловые эффекты принято указывать в уравнениях реакций. Такиеуравнения с обозначенным тепловым эффектом называются термохимическими. Например, термохимическое уравнение рассмотренной в примере 2.2 реакции записывается:
Если условия отличаются от стандартных, в практических термохимических расчётах допускается использование приближения:ΔН ≈ΔН°298 (2.4)Выражение(2.4) отражает слабую зависимость величины теплоты реакции от условий её протекания.
Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Тепловой эффект химической реакции. Термохимическое уравнение
Содержание:
Когда исходные вещества начинают реагировать друг с другом, то происходит взаимодействие молекул между собой. При этом выделяется большое количество энергии, после образования окончательных продуктов. Во время разрушения кристаллической решетки, поглощается тепло. Оно имеет разные формы: энергию, свет, фотоны, звук.
Тепловой эффект химической реакции
Тепловой эффект – это количества тепла или энергии, которое выделилось или поглотилось во время химической реакции, относительно 1 моль вещества. В химии тепловой эффект обозначают символом Q, измеряют в ккал/моль или кДж/моль. Согласно определению выделяют два типа процессов:
Чем больше прореагирует химического вещества, тем больше выделиться энергии. Следовательно, тепловой эффект зависит от химического вещества в моль вступившего в реакцию.
Экзотермическая реакция
По энергии ионизации реагенты в эндотермической реакции находятся выше оси нулевой энергии, т.е. скорость прямой реакции выше, чем обратной и наоборот, в эндотермических реакциях – скорость обратной реакции выше, чем прямой.
Термохимическое уравнение
Химические уравнения, в которых отображается тепловой эффект называются термохимическими. При записи в скобках обязательно указывают агрегатное состояние вещества: твердое, жидкое, газообразное и другое. Коэффициенты прописываются в условии: дробные или цельные числа.
При расчете учитывают температуру и давление, при которых протекает процесс. Если в условиях задачи не прописаны значения, то их принимают как стандартные: температура 278К, а давление 110,3 кПа.
В конце записи химического уравнения записывают значение Q0, которое берут в справочнике, отдельно для каждого вещества. Энергия представлена в кДж в стандартных условиях. Применяется для расчета по формулам.
Расчеты по термохимическим уравнениям
Термохимические уравнения записываются в готовом виде с коэффициентами, представленной энергией. Целью задачи обычно стоит выяснить массу прореагировавшего вещества или выяснить потраченную энергию до десятых.
Для правильного расчета необходимо знать правила составления пропорции и формулу для расчета химического количества вещества в 1 моле.
Примеры задач
Задача 1
45 г глюкозы (С6Н12О6) подвергли обработке избытком кислорода, в результате чего выделилось 700 кДж энергии. Выясните значение теплового эффекта? Реакция протекала по следующей формуле:
Найдем химическое количество глюкозы:
Получается, что при взаимодействии 0,25 моль вещества образуется 700 кДж энергии. Тепловой эффект приравнивают к значению 1 моль. Следовательно, составим пропорцию:
Q = (1* 700) : 0,25 = 700 : 0,25 = 2800 кДж
Задача 2
Представлено термохимическое уравнение, в процессе которого выделилось 3330 кДж энергии, образовалось 68 г Al2O3.Рассчитайте какое количества тепла выделилось, уравнение имеет следующий вид:
Найдем химическое количество оксида алюминия(III):
Исходя из исходного уравнения, для получения 4 моль оксида алюминия(III) расходуется 3330 кДж энергии, для того, чтобы выяснить, сколько выделяется тепла для 68 г, нужно составить пропорцию:
Q = (0,667 * 3330) : 4 = 2,221 : 4 = 555 кДж;
Закон Гесса
В 1840 году русский ученый описал закон термохимии, который до сих пор используется. Его называют законом Гесса:
Это правило помогает узнать тепловой эффект промежуточных стадий. Он будет равен разнице между начальным и конечным значением. По сумме переходных реакций выясняют общий тепловой эффект.
Тепловой эффект химических реакций
Количество теплоты, которые выделяется или поглощается в результате реакции, называют тепловым эффектом данной реакции.
Qp = Qкон. — Qисх.
Как рассчитать теплоту химия
Задачи Химическая термодинамика и термохимия
Задачи по теме химическая термодинамика и термохимия с решениями
1. Задача Расчёт тепловых эффектов химической реакции.
Решение задачи. Термохимическое уравнение имеет вид:
CaO(т) + H2O(ж) → Ca(OH)2(т), где т, ж – твёрдое и жидкое агрегатное состояние.
Рассчитываем тепловой эффект реакции в стандартных условиях (ΔH°р-ции), используя следствие из закона Гесса:
Рассчитаем тепловой эффект реакции с учётом количества вещества оксида кальция:
ΔHр-ции = nCaO* ΔH°р-ции; nCaO = 
2. Задача Расчёт теплот образования веществ.
Решение задачи. Термохимическое уравнение имеет вид:
CaC2(т) + 2H2O(ж) → Ca(OH)2(т) + C2H2(г), где т, ж и г – соответственно, твёрдое, жидкое и газообразное агрегатное состояние.
Рассчитаем тепловой эффект реакции в стандартных условиях (ΔH°р-ции):
ΔH°р-ции = 
Выразим и рассчитаем теплоту образования гидроксида кальция, используя следствие из закона Гесса:
ΔH°р-ции = ΔH° Ca(OH)2 + ΔH° C2H2 – (ΔH° CaС2 – 2*ΔH° H2О), при этом учитываем стехиометрические коэффициенты в уравнении реакции.
3. Задача Расчёт теплоты растворения.
Рассчитать теплоту растворения кристаллогидрата сульфита натрия (Na2SO3 * 7H2O), если теплота растворения безводного сульфита натрия равна 11,34 кДж/моль, а теплота образования кристаллогидрата этой соли (теплота гидратации) равна 58,4 кДж/моль.
Решение задачи. Теплота растворения безводного сульфита натрия складывается из теплоты, пошедшей на разрушение кристаллической решётки безводной соли, и теплоты, выделившейся при гидратации соли:
Na2SO3 + 7H2O → Na2SO3 * 7H2O,
ΔH° растворения = ΔH° разруш. крист. решётки + ΔH° гидратации;
теплота растворения кристаллогидрата равна:
Задача Расчёт теплоты сгорания.
Рассчитать стандартную теплоту сгорания этилового спирта, исходя из реакции биохимического брожения глюкозы:
Решение задачи. Используем ещё одно следствие из закона Гесса: тепловой эффект реакции равен разности между суммами теплот сгорания исходных веществ и суммами теплот сгорания продуктов реакции: ΔH°р-ции = ΔH°сгор.С6Н12О6 – (2*ΔH°сгор.С2Н5ОН + 2ΔH°СО2). Поскольку углекислый газ уже не может окисляться, то его теплота сгорания (окисления) равна нулю.
ΔH°сгор.С2Н5ОН = 
Задачи по теме Расчёт изменения внутренней энергии при химических реакциях и фазовых переходах.
Задача 1. Рассчитать изменение внутренней энергии системы в стандартных условиях (ΔU°) при протекании реакции
Решение. Изменение внутренней энергии рассчитывается по формуле ΔU=ΔH-A, для газов A (работа расширения) = Δn*R*T →
Рассчитаем ΔH°р-ции, используя следствие из закона Гесса:
Рассчитываем изменение внутренней энергии:
Следовательно, в процессе реакции внутренняя энергия увеличилась на 112 кДж/моль.
Задача 2. Рассчитать изменение внутренней энергии при испарении 250 г воды при 20°С (пары подчиняются законам идеальных газов). Объёмом жидкости по сравнению с объёмом пара можно пренебречь. Удельная теплота парообразования воды равна 2451 Дж/г.
ΔH = 2451 Дж/г * 18 г/моль = 44,12 кДж/моль,
Следовательно, внутренняя энергия системы увеличилась на 579,0 кДж.
Примеры решения типовых задач по второму началу термодинамики.
При решении задач указывать и учитывать агрегатное состояние веществ.
Задачи по Определение изменения энтропии в различных процессах.
Особенностью химических и физико-химических превращений является участие в них большого числа частиц. Для таких систем наиболее вероятно состояние беспорядка (частицы менее связаны, менее упорядочены), которое характеризуется энтропией (S). Количественно изменение энтропии можно рассчитать на основе следствия закона Гесса. Чем большее увеличение энтропии в каком-либо процессе, тем этот процесс более вероятен. Качественно знак изменения энтропии можно оценить (определить), сопоставляя число частиц до и после реакции и агрегатное состояние исходных веществ и продуктов реакции.
Энтропия связана с теплотой и возрастает при увеличении беспорядка:
— переход из твёрдого состояния жидкое, из жидкого – в газообразное;
— увеличение числа частиц.
Энтропия уменьшается при возрастании упорядоченности (взаимодействие частиц увеличивается):
— конденсация паров, сжижение;
— уменьшение числа частиц.
Задача 1. Определить знак изменения энтропии в реакциях:
Решение. Знак изменения энтропии можно установить по количеству частиц исходных и конечных веществ:
Наступление равновесия возможно, если знак изменения функций ΔH и Δ S одинаков
Задачи по расчету констант равновесия.
Зависимость константы равновесия от свободной энергии Гиббса выражается уравнением:
Задача. Константа равновесия реакции С(Т) + СО2(г)↔ 2СО (г) при 1700°К равна 2,4. Рассчитать ΔGр-ции при 1700°К и константу равновесия в стандартных условиях (298°К).