Как рассчитать сердечный индекс
Как рассчитать сердечный индекс
В клинической литературе чаще используют понятие «минутный объем кровообращения» (МОК).
В системе транспорта кислорода аппарат кровообращения является лимитирующим звеном, поэтому соотношение максимальной величины МОК, проявляющейся при максимально напряженной мышечной работе, с его значением в условиях основного обмена дает представление о функциональном резерве сердечно-сосудистой системы. Это же соотношение отражает и функциональный резерв сердца в его гемодинамической функции. Гемодинамический функциональный резерв сердца у здоровых людей составляет 300—400 %. Это означает, что МОК покоя может быть увеличен в 3—4 раза. У физически тренированных лиц функциональный резерв выше — он достигает 500—700 %.
Для условий физического покоя и горизонтального положения тела испытуемого нормальные величины минутного объема кровообращения ( МОК ) соответствуют диапазону 4—6 л/ мин (чаще приводятся величины 5—5,5 л/мин). Средние величины сердечного индекса колеблются от 2 до 4 л/(мин • м2) — чаще приводятся величины порядка 3—3,5 л/(мин • м2).
Поскольку объем крови у человека составляет только 5—6 л, полный кругооборот всего объема крови происходит примерно за 1 мин. В период тяжелой работы МОК у здорового человека может увеличиваться до 25— 30 л/мин, а у спортсменов — до 30—40 л/мин.
Факторами, определяющими величину величины минутного объема кровообращения ( МОК ), являются систолический объем крови, частота сердечных сокращений и венозный возврат крови к сердцу.
Систолический объем крови. Объем крови, нагнетаемый каждым желудочком в магистральный сосуд (аорту или легочную артерию) при одном сокращении сердца, обозначают как систолический, или ударный, объем крови.
В покое объем крови, выбрасываемый из желудочка, составляет в норме от трети до половины общего количества крови, содержащейся в этой камере сердца к концу диастолы. Оставшийся в сердце после систолы резервный объем крови является своеобразным депо, обеспечивающим увеличение сердечного выброса при ситуациях, в которых требуется быстрая интенсификация гемодинамики (например, при физической нагрузке, эмоциональном стрессе и др.).
Таблица 9.3. Некоторые параметры системной гемодинамики и насосной функции сердца у человека (в условиях основного обмена)
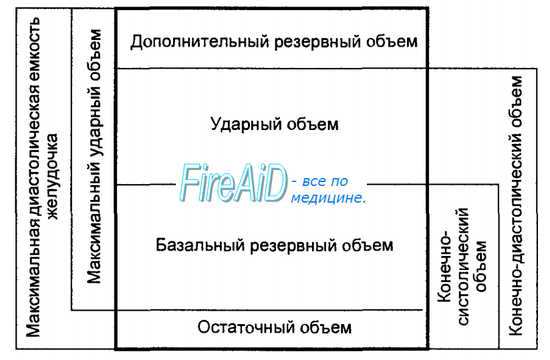
Величина систолического (ударного) объема крови во многом предопределена конечным диастолическим объемом желудочков. В условиях покоя диастолическая емкость желудочков сердца подразделяется на три фракции: ударного объема, базального резервного объема и остаточного объема. Все эти три фракции суммарно составляют конечно-диастолический объем крови, содержащийся в желудочках (рис. 9.4).
После выброса в аорту систолического объема крови оставшейся в желудочке объем крови — это конечно-систолический объем. Он подразделяется на базальный резервный объем и остаточный объем. Базальный резервный объем — это количество крови, которое может быть дополнительно выброшено из желудочка при увеличении силы сокращений миокарда (например, при физической нагрузке организма). Остаточный объем — это то количество крови, которое не может быть вытолкнуто из желудочка даже при самом мощном сердечном сокращении (см. рис. 9.4).
Величина резервного объема крови является одной из главных детерминант функционального резерва сердца по его специфической функции — перемещению крови в системе. При увеличении резервного объема, соответственно, увеличивается максимальный систолический объем, который может быть выброшен из сердца в условиях его интенсивной деятельности.
Регуляторные влияния на сердце реализуются в изменении систолического объема путем воздействия на сократительную силу миокарда. При уменьшении мощности сердечного сокращения систолический объем снижается.
У человека при горизонтальном положении тела в условиях покоя систолический объем составляет от 60 до 90 мл (табл. 9.3).
Сердечный индекс
Исследование здоровья человека с сердечно-сосудистыми заболеваниями нуждается в определении «запасов» и функциональных возможностей. Особенно важны подобные характеристики в подборе тактики лечения тяжелых случаев, кардиогенного и токсического шока, при подготовке к оперативным вмешательствам на сердце.
Сердечный индекс не измеряется каким-либо прибором. Он относится к группе расчетных показателей. Это означает, что для его определения необходимо знать другие величины.
Какие показатели необходимо измерить для расчета сердечного индекса?
Для определения сердечного индекса нужны:
Минутный объем кровообращения или сердечный выброс — измеряемый показатель. Его определяют с помощью специальных датчиков, находящихся на конце плавающего катетера.
Методика называется «термодилюцией». Используется регистрация разведения и «согревания» введенного физраствора или глюкозы (необходимо 5–10 мл) комнатной температуры до внутренней температуры в кровяном русле. Компьютерные программы в состоянии зарегистрировать и быстро вычислить необходимые параметры.
Следует точно соблюдать требования к методике, поскольку нарушение приводит к неточным результатам:
Чтобы рассчитать площадь общей поверхности человеческого тела, используют формулу Дю Буа, в которой скорректированные коэффициентами измеренные в кг вес тела и рост в метрах умножают на стандартный коэффициент 0,007184.
Общий вид формулы площади тела (S) в м2:
(вес х 0,423) х (рост х 0,725) х 0,007184.
Формула и расшифровка
Поэтому он повышается при увеличении выброса в случаях:
Уменьшение сердечного индекса сопутствует:
В здоровом организме колебания индекса возможны за счет возрастных особенностей и пола.
Резервные границы показателя
В горизонтальном положении, находясь в покое, минутный объем здорового человека составляет в среднем 5–5,5 л/мин. Соответственно, при этих же условиях средний сердечный индекс будет 3–3,5 л/мин*м2.
При высоких физических нагрузках функциональные возможности сердечной мышцы возрастают до 300–400%. За минуту перекачивается 25–30 л крови.
Величина сердечного индекса изменяется прямо пропорционально.
Особенности оценки показателя
Сердечный индекс позволяет правильно подобрать лечение на разных стадиях шока и получить более точную диагностическую информацию.
Важно иметь в виду, что этот показатель никогда не оценивается самостоятельно. Он входит в группу гемодинамических величин в качестве равнозначимой информации совместно с:
Особенности возрастных изменений
С возрастом изменяется минутный объем крови, от которого зависит сердечный индекс. Из-за замедления сокращений сердца увеличивается ударный объем (за одно сокращение). Так у новорожденного малыша он на уровне 2,5 мл, в годовалом возрасте — 10,2 мл, а к 16 годам повышается до 60 мл.
У взрослого человека этот показатель составляет от 60 до 80 мл.
Показатель одинаков у мальчиков и девочек. Но с 11 лет он растет у мальчиков быстрее, и к 16 годам определяется небольшая разница: у юношей выше, чем у девушек. Но поскольку одновременно нарастает и масса, рост (а значит и площадь общей поверхности тела), то сердечный индекс не увеличивается, а даже уменьшается на 40%.
Современное оборудование не требует ручных расчетов, а выдает комплексный результат анализа. Специалист сравнивает его со стандартными нормативами, проводит соотношение с другими аналитическими данными и судит о размере компенсаторных возможностей или патологических изменений.
Научная электронная библиотека
2.3. Методы исследования эндокринного и вегетативного статуса испытуемых
Методики определения концентрации гормонов
Комплексный характер наших исследований обеспечивался определением концентраций гормонов стресс-группы (АКТГ, альдостерон, кортизол), а также позволяющих контролировать функциональное состояние внутренних органов (инсулин, гастрин), эндокринных желез (щитовидная железа, паращитовидная), а также оценивать активность репаративного процесса (остеокальцин, циклические нуклеотиды, соматотропин).
Содержание гормонов в крови (АКТГ, кальцитонин, паратирин, альдостерон, кортизол, соматотропин), а также остеокальцина и соматотропина, инсулина определяли методом радиоиммунологического анализа с использованием наборов реагентов фирмы «Cea Ire Sorin bio international» (Франция), цАМФ и цГМФ – наборами фирмы «Amersham» (Англия). Подсчет величины активности и расчет концентрации гормонов проводился на гамма- и бета-счетчика фирмы «Tracor Europa» (Голландия).
Концентрацию катехоламинов – адреналина (А) и норадреналина (НА) определяли спектрофотометрическими методами на анализаторе фирмы Eppendorf «EPАK 6140», используя стандартные наборы реактивов фирмы Raichem. Определяли их коэффициенты – НА/А.
Определяли концентрацию циклических нуклеотидов (цАМФ и цГМФ) – радиоконкурентным методом и устанавливали отношение цАМФ/цГМФ.
Методики изучения вегетативных функций
Для оценки вегетативных функций использовали комплекс традиционных показателей – частоту сердечных сокращений (ЧСС), частоту дыхательных движений (ЧДД), систолическое (САД) и диастолическое (ДАД) артериальное давление, на основе измерения которых рассчитывали различные коэффициенты и индексы внутри- и межсистемных рассогласований.
Измерение артериального давления проводили в положении сидя по методу Короткова с использованием сфигмоманометра. Определяли максимальное (систолическое) и минимальное (диастолическое) артериальное давление (САД и ДАД).
Артериальное давление (АД) и частоту сердечных сокращений (ЧСС) измеряли с помощью аппарата для измерения этих показателей UA-707 фирмы «AD Company Limited» (Japan). Частоту дыхательных движений (ЧДД) определяли путем наблюдения за движениями грудной клетки испытуемого.
Среднее динамическое давление (СДД) рассчитывали по формуле Вецлера и Богера:
СДД = 0,42·САД + 0,58·ДАД.
Этот показатель является одной из интегральных результирующих кровообращения.
Ударный объем (УО) определяли по формуле Старра-Акуель (1997), основываясь на том, что этот параметр детерминирован пульсовым давлением и возрастом:
УО = 100 + 0,5·САД – 1,1·ДАД – 0,6·Возраст + ППСА,
где ППСА – площадь поперечного сечения аорты (находили по номограмме Н.Н. Савицкого).
Отсюда определяли минутный объем кровообращения (МОК):
Этот показатель сравнивали с должным минутным объемом кровообращения (ДМОК):
где ДОО – должный основной обмен, который, в свою очередь, находили по формулам Гарриса и Бенедикта:
ДОО = 9,56·Вес +1,85·Рост + 4,67·Возраст + 65,09/для женщин/.
Коэффициент Хильденбранта (КХ) рассчитывали по формуле:
Этот коэффициент указывает на сбалансированность взаимодействий сердечно-сосудистой и дыхательной систем (чем он выше, тем больше дисрегуляция).
Двойное произведение (ДП) определяли по формуле:
Чем выше этот показатель, тем большую работу производит сердечная мышца (В. Robinson, 1967). Его снижение может свидетельствовать, например, о начале развития коронарной патологии.
Индекс Аллговера (ИА) рассчитывался по формуле:
Этот индекс в обратной величине выражает уменьшение систолического выброса, главного прогностического показателя кровообращения.
Для оценки влияний вегетативной нервной системы мы использовали определение вегетативного индекса Кердо (ВИК) по формуле:
Количество единиц со знаком (–) означает преобладание ваготонии, а со знаком (+) симпатикотонии. При равновесии в состоянии вегетативной нервной системы этот показатель равен нулю. Положительный индекс Кердо свидетельствует об усилении процессов катаболизма, характерного для напряжённого функционирования и расходования резервов организма, отрицательный – о более благоприятном, анаболическом варианте метаболизма и экономном режиме функционирования. Этот показатель отражает степень приспособления организма к окружающим условиям, при котором отклонение от нулевой линии рассматривается как признак нарушения адаптационных механизмов.
Коэффициент выносливости (КВ) рассчитывали по формуле А. Квааса:
Принято считать, что увеличение данного показателя свидетельствует об ослаблении, а снижение указывает на увеличение функциональных возможностей сердечно-сосудистой системы.
Коэффициент экономичности кровообращения (КЭК) определяли по формуле:
Этот параметр характеризует затраты организма на передвижение крови в сосудистом русле. Принято считать, что чем он больше, тем экономичнее происходит расходование резервов сердечно-сосудистой системы.
Перечисленные индексы и коэффициенты могут указывать на перенапряжение регуляторных систем.
Систолический (S) минутный (M) объем кровообращения рассчитывается по формуле Лилиенистранда и Цандера:
где Pd – пульсовое давление, оно находится по формуле:
P – среднее давление, оно вычисляется так:
Среднее давление Pcр можно также рассчитать по формуле (Б. Фолков и др., 1976):
Pcр = ДАД + (САД – ДАД)/3.
Для количественной оценки систолической функции сердца одновременно использовали нескольких методик: с помощью аппарата UA-707 фирмы «AD Company Limited» (Япония) измеряли систолическое и диастолическое артериальное давление (САД и ДАД) и частоту сердечных сокращений (ЧСС). Частоту дыхательных движений (ЧДД) определяли путем наблюдения. На основании этих данных производили расчеты коэффициентов и индексов, характеризующих системное кровообращение. Среднее динамическое давление (СДД) рассчитывали по формуле Вецлера и Богера:
СДД = 0,42·САД + 0,58·ДАД.
Этот показатель является одной из интегральных результирующих кровообращения, его изменения имеют важное диагностическое и прогностическое значение. Ударный объем сердца (УОС) определяли по формуле Старра-Акуель (1997), основываясь на том, что она детерминирована пульсовым давлением и возрастом:
УОС = 100 + 0,5·САД – 1,1·ДАД – 0,6·возраст + ППСА,
где ППСА – площадь поперечного сечения аорты (находили по номограмме Н.Н. Савицкого). Вычисляли минутный объем кровообращения (МОК):
Этот показатель сравнивали с должным минутным объемом кровообращения (ДМОК):
где ДОО – должный основной обмен, который, в свою очередь, находили по формулам Гарриса и Бенедикта:
ДОО = 9,56·Вес + 1,85·Рост + 4,67·Возраст + 65,09/для женщин/.
Какие шкалы должен использовать кардиолог у пациентов с фибрилляцией предсердий? Что нового?
Частота фибрилляции предсердий (ФП) у взрослых людей в популяции составляет 2-4% [1]. Она увеличивается с возрастом, в том числе под действием различных сопутствующих заболеваний и факторов риска, таких как артериальная гипертония, сахарный диабет, коронарная болезнь сердца, хроническая болезнь почек, ожирение, употребление алкоголя, курение и т.д. В ближайшие годы можно ожидать дальнейшего роста распространенности ФП не только за счет увеличения продолжительности жизни и постарения населения, но и внедрения новых систем скрининга нарушений ритма с помощью мобильных технологий (смартфонов), позволяющих зарегистрировать малосимптомные или бессимптомные нарушения ритма [2]. Например, в исследовании REHEARSE-AF регистрация ЭКГ в одном отведении с помощью смартфона/ планшета два раза в неделю в течение 12 мес у пациентов в возрасте ≥65 лет привела к увеличению частоты диагностики ФП в 3,9 раза по сравнению с обычной тактикой ведения [3]. Использование подобных устройств для скрининга ФП наиболее обосновано у людей пожилого и старческого возраста, а также пациентов с высоким риском инсульта [4].
ФП ассоциируется более чем с 3-кратным увеличением риска смерти [5] и является одной из основных причин инсульта (20-30% и 10% случаев ишемического и криптогенного инсульта, соответственно), который характеризуется тяжелым и рецидивирующим течением и часто приводит к смерти или инвалидизации [1]. ФП сопровождается нарушением функции сердца и развитием сердечной недостаточности, как со сниженной, так и сохраненной фракцией выброса левого желудочка, которая наблюдается у 20-30% таких больных и вызывает дополнительное ухудшение прогноза для жизни [6]. Неблагоприятные последствия ФП включают в себя также снижение качества жизни, особенно у женщин [7], когнитивные расстройства вплоть до деменции [8] и частые госпитализации, ассоциирующиеся с увеличением затрат для системы здравоохранения [9]. По данным мета-анализа 35 исследований в целом более чем у 300000 больных с ФП частота госпитализаций составила в среднем 43,7 на 100 пациентов в год, а одним из основных факторов, ассоциировавшихся с увеличением вероятности поступления в стационар, был пожилой возраст [10].
Ведение больных с ФП
Антикоагулянтная терапия
Для оценки риска инсульта у больных с ФП и, соответственно, необходимости в применении антикоагулянтов используют шкалу CHA2DS2-VASc (табл. 1), которая включает в себя хроническую сердечную недостаточность (ХСН), артериальную гипертонию, возраст ≥75 лет, сахарный диабет, инсульт/транзиторную ишемическую атаку (ТИА)/системную эмболию в анамнезе, сердечно-сосудистое заболевание, в том числе стенозирующий коронарный атеросклероз, подтвержденный при ангиографии, перенесенный инфаркт миокарда, атеросклероз периферических артерий или бляшку в аорте, возраст 65-74 года и женский пол [18]. Необ ходимо отметить, что женский пол скорее модифицирует общий риск развития инсульта, чем является фактором риска сам по себе [19], так как при отсутствии дополнительных факторов риска у женщин вероятность развития инсульта такая же низкая как у мужчин с индексом по шкале CHA2DS2-VASc, равным 0. В то же время при наличии по крайней мере одного дополнительного фактора риска у женщин вероятность инсульта увеличивается в большей степени, чем у мужчин [20].
Склонность к падениям сама по себе не является независимым фактором риска кровотечения на фоне антикоагулянтной терапии, однако травма при падении у пожилого пациента, принимающего пероральные антикоагулянты, может привести к более тяжелому кровотечению, например, внутричерепному. Любопытные данные были получены в одном исследовании, в котором моделировались эффекты падений у пациентов, получающих пероральные антикоагулянты. Авторы показали, что пациенты, принимающие варфарин, должны падать примерно 295 раз в год, чтобы угроза серьезного кровотечений перевесила пользу снижения риска ишемического инсульта [26]. Тем не менее, приведенные данные не отменяют необходимость профилактики падений с помощью простых мер, таких как использование вспомогательных устройств при ходьбе, ношение соответствующей обуви, устранение препятствий для пожилого человека в квартире (ковры, лишняя мебель) и т.д.
Показания к назначению пероральных антикоагулянтов в новых рекомендациях Европейского общества кардиологов не изменились. Их применение необходимо, если значение индекса по шкале CHA2DS2-VASc составляет по крайней мере 2 у мужчин и 3 у женщин. Это означает, что пероральные антикоагулянты следует назначать всем больным с ФП (независимо от пола), достигшим возраста 75 лет, и пациентам в возрасте 6574 года при наличии по крайней мере одного дополнительного фактора риска инсульта, например, артериальной гипертонии или сахарного диабета, в то время как в более молодом возрасте основанием для антикоагуляции служит наличие по крайней мере двух факторов риска как у мужчин, так и у женщин (рис. 2). Если индекс по шкале CHA2DS2-VASc составляет 1 у мужчин или 2 у женщин, то антикоагулянтную терапию считают возможной, хотя четкие показания к ее назначению в таких случаях в рекомендациях не приводятся. ФП обычно развивается у людей пожилого и старческого возраста, страдающих различными заболеваниями, поэтому индекс по шкале CHA2DS2-VASc у большинства больных с этой аритмией превышает указанные значения, обосновывая применение антикоагулянтов. Кроме того, индекс CHA2DS2-VASc имеет тенденцию к увеличению как за счет возраста, так и присоединения новых заболеваний, повышающих риск инсульта. Необходимо еще раз подчеркнуть, что тип ФП (пароксизмальная/персистирующая или постоянная) не имеет значения для решения вопроса об антикоагулянтной терапии и не учитывается при расчете индекса по шкале CHA2DS2-VASc.
Для профилактики инсульта у пациентов с неклапанной ФП применяют антагонисты витамина К, прежде всего варфарин, или прямые оральные антикоагулянты (ПОАК), в том числе ривароксабан, апиксабан, дабигатрин и эдоксабан (последний не зарегистрирован в Российской Федерации). Комбинированная терапия ацетилсалициловой кислотой и клопидогрелом у таких пациентов по эффективности уступала варфарину и сопровождалась сопоставимым риском кровотечений [27], а монотерапия ацетилсалициловой кислотой оказалась неэффективной и ассоциировалась с более высоким риском ишемического инсульта у пожилых людей с ФП [28]. Таким образом, антитромбоцитарные препараты не следует рассматривать как более безопасную альтернативу пероральным антикоагулянтам у пациентов с ФП, нуждающихся в эффективной профилактике инсульта.
В настоящее время ПОАК считают препаратами первой линии в профилактике инсульта у пациентов с неклапанной ФП [11]. В регистрационных клинических исследованиях все препараты этой группы по эффективности по крайне мере не уступали варфарину. Однако при мета-анализе клинических исследований у больных, получавших ПОАК, было выявлено снижение риска инсульта и системных эмболий на 19% по сравнению с таковым при лечении варфарином, снижение риска геморрагического инсульта на 51% и риска смерти от любых причин на 10%. Кроме того, при применении ПОАК было отмечено недостоверное снижение риска больших кровотечений на 14% и статистически значимое снижение риска внутричерепного кровотечения на 52%, в то время как частота желудочно-кишечных кровотечений увеличилась на 25% [29]. Эти данные позволяют рассматривать ПОАК в целом как более эффективную и безопасную альтернативу непрямым антикоагулянтам.
В отличие от ПОАК, варфарин может взаимодействовать с различными лекарственными препаратами, которые могут усилить или, наоборот, ослабить его антикоагулянтное действие. При лечении непрямыми антикоагулянтами необходимо регулярно контролировать международное нормализованное отношение (МНО) и при необходимости корректировать их дозы. В целом антагонисты витамина К считают эффективными и относительно безопасными препаратами, если МНО удается поддерживать в терапевтическом диапазоне более 70% времени, хотя добиться этого удается не всегда. Предложена шкала SAMe-TT2R2 (женский пол, возраст менее 60 лет, наличие по крайней мере двух сопутствующих заболеваний, таких как артериальная гипертония, сахарный диабет, ИБС, атеросклероз периферических артерий, сердечная недостаточность, инсульт в анамнезе, заболевание легких и поражение печени или почек, лечение некоторыми препаратами, курение, неевропеоидная раса), которая позволяет выделить пациентов с ФП, у которых труднее обеспечить адекватный антикоагулянтный эффект варфарина [30]. Величина индекса по этой шкале >2 служит дополнительным доводом в пользу выбора ПОАК. Если больному все же приходится назначить варфарин или другой антагонист витамина К (обычно по экономическим причинам), то необходимо принимать дополнительные меры, чтобы повысить эффективность и безопасность терапии, например, более частое мониторирование МНО, повторные консультации и т.п.
Профиль эффективности ПОАК в профилактике инсульта у пациентов с неклапанной ФП подтвержден также в пострегистрационных исследованиях, результаты которых соответствовали таковым рандомизированных контролируемых исследований 32. P. Kirchhof и соавт. обобщили результаты применения ривароксабана у 11121 пациента с неклапанной ФП (средний возраст 70,5±10,5 лет; 42,9% женщин), включенных в исследования, которые проводились в обычной клинической практике в 47 странах в рамках программы XANTUS (Xarelto for Prevention of Stroke in Patients With Atrial Fibrillation) [34]. Проспективный дизайн исследований повышает клиническую ценность полученных данных. Пациентов с ФП, начавших прием ривароксабана, наблюдали в течение 1 года. Частота больших кровотечений составила в среднем 1,7 на 100-пациентолет, смерти от любых причин – 1,9 на 100 пациентолет, инсульта и системных эмболий – 1,0 на 100 пациенто-лет. Для сравнения, частота первичной конечной точки, включавшей в себя инсульт и системные эмболии, в рандомизированном исследовании ROCKET AF, подтвердившем эффективность ривароксабана в профилактике инсульта у пациентов с неклапанной ФП, составила 1,7 на 100 пациенто-лет [35]. Частота как кровотечений, так и инсульта была низкой во всех странах, принимавших участие в программе XANTUS, а доля пациентов, продолжавших прием ривароксабана в течение года, равнялась 77,4% (от 66,4% в странах Восточной Азии до 84,4% в Западной Европе). Высокая приверженность к приему антикоагулянтной терапии отражает удобство применения ривароксабана, в том числе отсутствие необходимости в титровании дозы и регулярном мониторировании МНО, низкий риск взаимодействия с другими лекарственными средствами, стабильность антикоагулянтного эффекта и возможность назначения один раз в день [36].
Все ПОАК частично выводятся почками – в большей степени дабигатран и в меньшей степени ривароксабан и апиксабан, поэтому при выборе препарата и его дозы следует учитывать функцию почек. Например, дозу ривароксабана у пациентов с клиренсом креатинина 1549 мл/мин следует снизить с 20 до 15 мг один раз в день. Чтобы обеспечить безопасность антикоагулянтной терапии у больных с ФП, необходимо регулярно контролировать функцию почек с помощью клиренса креатитина, рассчитанного по формуле Кокрофта-Гоулта, так как именно этот показатель использовался в регистрационных клинических исследованиях. Оценивать функцию почек следует по крайней мере один раз в год или чаще у пациентов, относящихся к группе риска, например, при наличии исходного снижения функции почек. У пациентов с нарушенной и/или ухудшающейся функцией почек целесообразно рассмотреть применение ПОАК, которые в меньшей степени выводятся почками (ривароксабан или апиксабан). В практическом руководстве Европейской ассоциации аритмологов клиренс креатинина рекомендовано измерять каждые 6 мес у больных в возрасте ≥75 лет (особенно при лечении дабигатраном) и «хрупких» пациентов [37]. Чтобы оценить минимальный интервал определения клиренса креатинина у пациентов с исходно сниженной функцией почек клиренс креатинина следует разделить на 10. Например, у пациентов с его значением 40 мл/мин, клиренс креатинина следует измерять по крайней мере каждые 4 мес. Необходимо учитывать, что функция почек может быстро ухудшиться под влиянием различных интеркуррентных заболеваний, например, инфекций или острой сердечной недостаточности. Соответственно, в таких случаях необходимо также измерить клиренс креатинина.
ФП примерно в трети случаев сочетается с хронической болезнью почек (ХБП) III-V стадии, т.е. снижением расчетной скорости клубочковой фильтрации (СКФ)
Улучшение контроля симптомов
Для оценки симптомов (сердцебиение, одышка, утомляемость, дискомфорт в груди и др.) ФП используют шкалу, предложенную Европейской ассоциацией аритмологов (EHRA) и отражающую влияние проявлений аритмии на обычную повседневную активность пациентов (табл. 3) [46,47]. Необходимо учитывать, что все указанные симптомы неспецифичны и могут быть следствием сопутствующих заболеваний, а подтвердить их связь с ФП иногда удается только ретроспективно. В рекомендациях Европейского общества кардиологов предлагается также оценивать тяжесть нагрузки ФП, которая отражает ее тип, общую длительность сохранения нарушения ритма при мониторировании ЭКГ, например, в течение 24 ч, число эпизодов аритмии, их максимальную длительность и т.п. [11]. Следует отметить, что в рекомендациях отсутствуют четкие критерии интепретации полученных данных. В некоторых исследованиях была выявлена ассоциация между параметрами нагрузки ФП и неблагоприятными клиническими исходами. A. Ganesan и соавт. при мета-анализе 12 исследований примерно у 100000 больных с непароксизмальной неклапанной ФП выявили увеличение риска тромбоэмболий и смерти (относительный риск 1,384; p ТАБЛИЦА 3. Шкала оценки выраженности симптомов ФП (EHRA)
Амиодарон остается самым эффективным антиаритмическим препаратом у больных с ФП, в том числе с сердечной недостаточностью и низкой фракцией выброса левого желудочка. В рекомендациях указано, что с учетом экстракардиальной токсичности амиодарона для длительного контроля синусового ритма у пациентов с ФП желательно по возможности применять другие антиаритмические препараты [11]. Тем не менее, как и в предыдущих версиях рекомендаций, другие антиаритмические средства, такие как пропафенон и соталол, рекомендовано использовать только при отсутствии признаков значительного структурного поражения сердца. Соталол может применяться у пациентов с ишемической болезнью сердца под тщательным контролем интервала QT, сывороточных уровней калия, клиренса креатинина и других факторов риска аритмогенного действия. К последним относят пожилой возраст, женский пол, нарушение функции почек и/или печени, коронарную болезнь сердца, гипокалиемию, случаи внезапной смерти у родственников. Анти арит мическую терапию не следует назначать пациентам с постоянной формой ФП, которые получают урежающие ритм препараты, а также больным с выраженными нарушениями проводимости, если им не установлен водитель ритма.
Лечение сердечно-сосудистых и других сопутствующих заболеваний
Сердечно-сосудистые заболевания и факторы риска, с одной стороны, способствуют развитию и рецидированию ФП, а, с другой стороны, сами могут быть причиной неблагоприятных исходов, в том числе инсульта, инфаркта и смерти. A. Gómez-Outes и соавт. провели мета-анализ 4 клинических исследований, в которых ПОАК сравнивали с варфарином в целом у 71683 больных с неклапанной ФП [55]. Во время периода наблюдения умерли 9% из них, а скорректированная смертность составила 4,72% в год. Доля сердечных причин в структуре общей смертности составила 46%. Основными факторами риска смерти от любых причин были сердечная недостаточность, постоянная/персистирующая ФП, сахарный диабет, мужской пол, пожилой возраст и сниженный клиренс креатинина. Сходные данные были получены в одном из исследований, включенных в мета-анализ, – ROCKET AF, в котором изучался ривароксабан [56]. Приведенные данные указывают на важность модификации сердечнососудистых факторов риска для улучшения прогноза у больных с неклапанной ФП.
Предложены шкалы, позволяющие стратифицировать больных с неклапанной ФП по риску основных сердечно-сосудистых событий, в том числе смертель ного и несмертельного инфаркта миокарда, реваску ляризации коронарных артерий и смерти от сердечно-сосудистых причин. Например, на основании проспективного когортного исследования у 1019 пациентов с ФП разработан индекс 2MACE, который рассчитывается с учетом возраста и наличия метаболического синдрома, застойной сердечной недоста точности и инфаркта миокарда/реваскуляризации коронарных артерий и тромбоэмболий в анамнезе (табл. 4) [57]. Величина индекса 2MACE варьируется от 0 до 7, а его значение ≥3 позволяло с высокой чувствительностью и специфичностью предсказать развитие неблагоприятных исходов у пациентов с неклапанной ФП (отношение рисков 3,92, 95% ДИ 2,41-6,40, p ТАБЛИЦА 4. Шкала 2MACE, предназначенная для оценки риска сердечно-сосудистых событий у пациентов с неклапанной ФП
Заключение
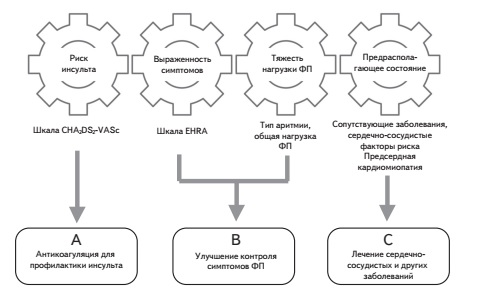
Современная стратегия лечения больных с неклапанной ФП, которая подробно рассматривается в рекомендациях Европейского общества кардиологов 2020 г., предполагает антикоагуляцию с целью профилактики инсульта и системных эмболий, улучшение контроля симптомов ФП путем урежения ЧСС или восстановления и удержания синусового ритма и оптимальное лечение сердечно-сосудистых и других сопутствующих заболеваний, которые в структуре смертности паци ентов с ФП занимают даже более важное место, чем ишемический инсульт. Накапливаются данные, демонстрирующие дополнительные преимущества ПОАК перед непрямыми антикоагулянтами. Например, в мета-анализах рандомизированных клинических исследованиях показано снижение риска развития инфаркта миокарда/ОКС при лечении ривароксабаном по срав нению с контролем. В ретроспективных исследованиях лечение ривароксабаном улучшало почечные исходы у пациентов с неклапанной ФП. Пациентам с ФП следует проводить структурированное обследование, включающее в себя оценку риска инсульта, выраженности симптомов, тяжести нагрузки ФП (тип аритмии, число и длительность эпизодов и т.п.) и предрасполагающего состояния. Важное значение имеет использование различных шкал, в том числе CHA2DS2-VASc (риск инсульта), HAS-BLED (риск кровотечения), EHRA (выраженность симптомов ФП) и 2MACE (риск сердечно-сосудистых исходов), которые помогают выбрать оптимальное лечение. Для более точной оценки риска инсульта и кровотечений у пациентов с ФП предложены новые шкалы на основе не только клинических показателей, но и лабораторных маркеров, однако их потенциальные преимущества перед существующими общепринятыми индексами нуждаются в подтверждении.
- часовой гипноз для связи с подсознанием слушать
- фнс россии рекомендована форма уведомления об уменьшении суммы налога на псн


