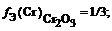Как рассчитать фактор эквивалентности
Как рассчитать фактор эквивалентности
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности ( f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
f Э (формульная единица вещества) º эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H 3 PO 4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности:
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 – Расчет фактора эквивалентности
Фактор эквивалентности
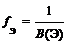
где В(Э) – валентность элемента
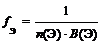
где n (Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента
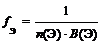
где n (Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента
f Э (P2O5) = 1/(2 × 5) = 1/10
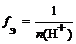
где n ( H + ) – число отданных в ходе реакции ионов водорода (основность кислоты)
f Э ( H 2 SO 4 ) = 1/1 = 1 (основность равна 1)
(основность равна 2)
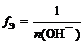
где n (О H – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
f Э ( Cu ( OH )2) = 1/1 = 1 (кислотность равна 1) или
(кислотность равна 2)
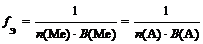
где n (Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n (А) – число кислотных остатков, В(А) – валентность кислотного остатка
f Э ( Cr 2 ( SO 4 )3) = 1/(3 × 2) = 1/6 (расчет по кислотному остатку)
Частица в окислительно-восстановительных реакциях
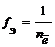
где 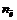
Fe 2+ + 2 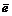
MnO4 – + 8H + + 5 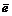
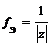
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl 2, б) КНСО3, в) ( MgOH )2 SO 4.
Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1.
а) ZnCl 2 (средняя соль):
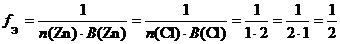
f Э( ZnCl 2) = 1/2, поэтому эквивалентом ZnCl 2 является частица 1/2 ZnCl 2.
б) КНСО3 (кислая соль):
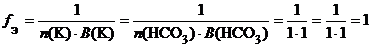
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3.
в) ( MgOH )2 SO 4 (основная соль):
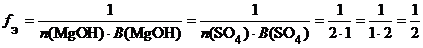
f Э ( ( MgOH )2 SO 4 ) = 1/2, поэтому эквивалентом ( MgOH )2 SO 4 является частица 1/2( MgOH )2 SO 4.
Эквивалент, как частица, может быть охарактеризован молярной массой (молярным объемом) и определенным количеством вещества n э. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
Молярная масса эквивалента имеет размерность «г/моль».
МЭ(соли) = МЭ(Ме) + МЭ(кислотного остатка).
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам . Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
n э(реагента1) = … = n э(реагента n ) = n э (продукта1) = … = n э (продукта n )
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
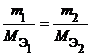
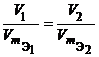
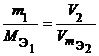
Определение фактора эквивалентности.
Определение фактора эквивалентности и числа эквивалентности
В этом посте рассмотрим два важных понятия, без которых понимание темы «Химический эквивалент» будет неполным: f – фактор эквивалентности и z – эквивалентное число.
Определение фактора эквивалентности и эквивалентного числа проводится только для конкретной ситуации. На схеме показаны такие ситуации.ры, казано числа эквивалентности
Если вспомнить сопоставление стоимости товара с химической частицей, о котором шла речь здесь, то фактор эквивалентности будет показывать долю «товара» (долю реальной частицы), которая соответствует одному рублю (иону водорода или электрону).
Определение фактора эквивалентностисвязано с нахождением числа эквивалентности z. Они являются обратнозависимыми величинами.
Смысл числа эквивалентности заключается в том, что оно показывает сколько эквивалентов содержится в одной частице вещества. Или иначе говоря показывает «сколько рублей стоит тот или иной товар»
Разберем все сказанное выше на примерах.
Taк, для реакции полной нейтрализации эквивалент серной кислоты Э (H2S04) = 1 /2 H2S04, т. e. эквивалентное число z = 2, a фактор эквивалентности f = 1 /2.
Рассмотрим несколько наиболее распространенных химических реакций. B реакции:
Попробуем записать уравнение этой реакции относительно одного иона водорода, тогда в уравнении реакции четко видно факторы эквивалентности:
Если таким образом проанализировать различные уравнения реакций нейтрализации, то можно увидеть общие закономерности: для кислот эквивалентное число равно числу замещаемых в конкретной реакции ионов водорода, a для оснований – числу замещаемых гидроксид-ионов.
Для реакций, в которых принимают участие соли, определение фактора эквивалентности и эквивалентов можно определить косвенными методами, например:
Чтобы определить эквиваленты A1C13 и AgN03, введем вспомогательные реакции:
3AgN03 + 3HCI = 3AgC1 + 3HN03
Одному иону водорода эквивалентна 1 /3 молекулы AICI3 x молекула AgN03, следовательно, Э(A1C13) = 1 /3AICI3, a Э(AgN03)= AgN03.
Рассмотрев несколько реакций c участием солей, мы убедимся, что эквивалентное число для соли равно произведению количества замещаемых ионов металла на заряд катиона или произведению числа замещаемых анионов кислотных остатков на их заряд.
Теперь перейдем к окислительно-восстановительным процессам.
B этом случае c одним ионом меди взаимодействуют два электрона, следовательно,
Эквивалентное число для иона меди равно числу отдаваемых электронов. B общем случае эквивалентное число в окислительно-восстановительных реакциях определяется числом электронов, которые отдает одна частица восстановителя или принимает одна частица окислителя. Например, рассмотрим реакцию:
Для веществ, в состав которых входят указанные ионы можем записать: Э(K2Cr207) = 1 /6K2Cr207; Э(CrCl3) = 1 /3CrC13; Э(HCl) = HCI.
По заданному условию для газа определите все остальные его параметры (незаполненные графы). Привести все расчеты, ответ представить в виде фрагмента данной таблицы.
| Вариант | Газ | Масса, г | Объем, л | Абсолютная масса одной молекулы | Количество вещества, моль | Число молекул |
| При p=100 кПа | При н.у. | |||||
| O2 | ||||||
| H2 | ||||||
| Cl2 | ||||||
| CH4 | ||||||
| F2 | 3∙10 23 | |||||
| SO2 | 0,1 | |||||
| H2S | 1∙10 23 | |||||
| Cl2O | ||||||
| NO | ||||||
| N2O | 0,5 | |||||
| NO2 | 1,5∙10 23 | |||||
| PH3 | 2,41 | |||||
| CO | 0,2 | |||||
| CO2 | 6,02 | |||||
| N2 | ||||||
| C2H6 | 0,5 | |||||
| H2 | 1,5 | |||||
| C3H8 | 0,6∙10 20 | |||||
| NH3 | 4,82 | |||||
| C2H2 | ||||||
| C4H10 | 1,5 | |||||
| Ar | ||||||
| He | 0,5∙10 23 | |||||
| HCl | 1,205 | |||||
| C2H4 |
PV=(m/M)*RT –ур-е Менделеева –Клапейрона
Количество молей = число частиц/ NA=m/M
Для определения массы молекулы m0 нужно разделить массу m вещества на число N молекул в нем:

Таким образом, чтобы найти массу молекулы вещества, нужно знать молярную массу вещества M и постоянную Авогадро NA. Молярная масса вещества обычно определяется химическими методами, постоянная Авогадро с высокой степенью точности определена несколькими физическими методами.
1 моль (1 М) воды = 6 . 10 23 молекул Н2О,
1 моль (1 М) железа = 6 . 10 23 атомов Fe,
1 моль (1 М) хлора = 6 . 10 23 молекул Cl2,
Теперь мы имеем удобную единицу количества вещества моль, с помощью которой легко отмерять равные порции молекул или атомов простым взвешиванием.
Разумеется, если мы увеличим или уменьшим взятое нами количество воды (18 г) и оксида кальция (56 г) в одинаковое количество раз, то и порции реагирующих молекул уменьшатся или возрастут во столько же раз.
Допустим, 1,8 г воды полностью прореагируют с 5,6 г СаО, а 180 г Н2О тоже без остатка прореагируют с 560 г СаО. Другими словами 0,1 моль воды прореагирует с 0,1 моль СаО, а 10 моль воды прореагируют с 10 моль СаО и т.д.
Например, молекулярная масса (молекулярный вес) метана CH4 составляет (12 + 4) = 16 а.е.м. Тогда для реакции горения метана:
справедливо, что из 1 моля метана получаются 2 моля воды и что из 16 г метана получается 2 . 18 = 36 г воды.
Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ. Она бозначается буквой М и имеет размерность г/моль. Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль).
Например, число молей в m г воды составляет: n = m/18. Для m г металлического натрия: n = m/23, и так далее.
И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 г.
Таблица 5-1. Молярные массы различных веществ.
| Вещество | Молекулярная или атомная масса (округлена) | молярная масса М |
| Вода Н2О | 18 а.е.м | 18 г/моль |
| СаО | 56 а.е.м. | 56 г/моль |
| Углерод 12 С | 12 а.е.м. | 12 г/моль |
| Медь Cu | 63,5 a.e.м. | 63,5 г/моль |
| Атом хлора Сl | 35,5 а.е.м. | 35,5 г/моль *) |
| Ион хлора Cl – | 35,5 а.е.м | 35,5 г/моль |
| Молекула хлора Cl2 | 71 а.е.м | 71 г/моль *) |
Как мы видим, термины «молекулярная масса» и «молярная масса» применимы не только к веществам молекулярного строения, но и к атомарным и ионным веществам. В таблице 5-1 каждая из указанных в правой колонке “порций” вещества содержит 6,02×10 23 структурных единиц этих веществ.
Молярная масса М – постоянная величина для каждого конкретного вещества. Без неё не обойтись при вычислении количества молей (n). Однако в дальнейшем для нас основным рабочим инструментом будет именно МОЛЬ вещества.
Рассчитайте: а) массовую долю растворенного вещества; б) молярную концентрацию; в) молярную концентрацию эквивалента; г) титр; д) мольную долю растворенного вещества растворов, полученных при растворении веществ в воде.
| Вариант | Растворенное вещество | Объем воды, мл | Плотность раствора, г/мл |
| формула | масса | ||
| H3PO4 | 1,036 | ||
| KOH | 1,280 | ||
| HNO3 | 1,210 | ||
| H2SO4 | 1,037 | ||
| NaOH | 1,090 | ||
| HCl | 1,100 | ||
| H3PO4 | 1,113 | ||
| KOH | 1,137 | ||
| HNO3 | 1,090 | ||
| H2SO4 | 1,120 | ||
| NaOH | 1,250 | ||
| HCl | 1,050 | ||
| H3PO4 | 1,210 | ||
| KOH | 1,220 | ||
| HNO3 | 1,070 | ||
| H2SO4 | 1,350 | ||
| NaOH | 1,430 | ||
| HCl | 1,150 | ||
| H3PO4 | 1,181 | ||
| KOH | 1,050 | ||
| HNO3 | 1,370 | ||
| H2SO4 | 1,037 | ||
| NaOH | 1,055 | ||
| HCl | 1,075 | ||
| H3PO4 | 1,028 |
Плотность воды = 0,998 г/см3=1г/см3
Массовая доля
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.

Массовое процентное содержание компонента, m%
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят 2 измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| Пример. Зависимость плотности растворов H2SO4 от её массовой доли в водном растворе при 25 °C [источник не указан 174 дня] | ||||||||||||
| ω, % | ||||||||||||
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Править] Объёмная доля
Основная статья: Объёмная доля
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.

Как и было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
[править] Молярность (молярная объёмная концентрация)
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации 

[править] Нормальная концентрация (мольная концентрация эквивалента, или просто «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Как правильно рассчитывать фактор эквивалентности элементов и веществ
Фактор эквивалентности хрома в соединениях
Определение фактора эквивалентности оксидов. кислот, оснований и солей
а) В2О3
Фактор эквивалентности оксида рассчитывается по формуле:
fЭ = 1/[(nЭ) . B(Э)], где
n(Э) – число атомов элемента (индекс в химической формуле оксида), В(Э) – валентность элемента.
fЭ(B2O3) = 1/(2 . 3) = 1/6, поэтому эквивалентом B2O3 является частица 1/2B2O3.
Зная фактор эквивалентности оксида бора, рассчитаем молярну массу эквивалента данного оксида1, получим:
МЭ(B2O3) = М(B2O3) . fЭ(B2O3) = 69,6182 г/моль . 1/6 = 11,6 г/моль.
б) NaOH
Фактор эквивалентности основания рассчитывается по формуле:
где n(ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания).
fЭ(NaOH) = 1/1 = 1 (кислотность равна 1), поэтому эквивалентом NaOH является частица 1NaOH.
Зная фактор эквивалентности гидроксида натрия, рассчитаем молярну массу эквивалента данного основания2, получим:
МЭ(NaOH) = М(NaOH) . fЭ(NaOH) = 40 г/моль . 1 = 40 г/моль.
в) H2SO3
Фактор эквивалентности кислоты рассчитывается по формуле:
n(H + ) – число отданных в ходе реакции ионов водорода (основность кислоты).
fЭ(H2SO3) = 1/2 (основность равна 2), поэтому эквивалентом H2SO3 является частица 1/2H2SO3.
Зная фактор эквивалентности сернистой кислоты, рассчитаем молярну массу эквивалента данной кислоты3, получим:
МЭ(H2SO3) = М(H2SO3) . fЭ(H2SO3) = 82 г/моль . 1/2 = 40 г/моль.
г) NaAl(SO4)2
М[NaAl(SO4)2] = 242 г/моль.
Фактор эквивалентности соли рассчитывается по формуле:
fЭ = 1/[n(Ме) . B(Me)] = 1/[n(A) . B(A)], где
n(Ме) – число атомов металла (индекс в химической формуле соли), В(Ме) – валентность металла; n(А) – число кислотных остатков, В(А) – валентность кислотного остатка.
Фактор эквивалентности сложной соли можно рассчитать по формуле:
fЭ = 1/<[n(Ме)1 . B(Me)2] + [n(Ме)1 . B(Me)2]> = 1/[n(A) . B(A)], где
n(Ме)1 и n(Ме)2 – число атомов металлов (первого и второго), В(Ме)1 и В(Ме)2 – валентности металлов (первого и второго); n(А) – число кислотных остатков, В(А) – валентность кислотного остатка.
fЭ[NaAl(SO4)2] = 1/<[n(Ме)1 . B(Me)2] + [n(Ме)1 . B(Me)2]> =
= 1/[n(A) . B(A)] = 1/[n(A) . B(A)] = 1[(1 . 1) / (1 . 3)] = 1/(2 . 2) = 1/4, поэтому эквивалентом NaAl(SO4)2 является частица 1/4NaAl(SO4)2.
Зная фактор эквивалентности сульфат алюмииния-наатрия, рассчитаем молярну массу эквивалента данной соли4, получим:
МЭ[NaAl(SO4)2] = М[NaAl(SO4)2] . fЭ[NaAl(SO4)2] = 242 г/моль . 1/4 = 60,5 г/моль.
Определение числа молей и числа эквивалентов в гидроксие титана (III)
Задача 234.
Определите число молей и число эквивалентов в 80 гидроксид титана (III) Ti(OH)3.
Решениие:
m[Ti(OH)3] = 80 г;
М[Ti(OH)3] = 98,89 г/моль ≈ 99 г/моль.
Фактор эквивалентности основания рассчитывается по формуле:
fЭ = 1/n(OH – ), где
где n(ОH – ) – число отданных в ходе реакции гидроксид-ионов (кислотность основания).
fЭ[Ti(OH)3] = 1/3 (кислотность равна 3), поэтому эквивалентом Ti(OH)3 является частица 1/3Ti(OH)3.
1. Определим число молей, получим:
2. Определим число эквивалентов, получим:
nfЭ[Ti(OH)3] = n[Ti(OH)3] . fЭ[Ti(OH)3] = 0,8 . 1/3 = 0,269 ≈ 0,27.
Определение объема эквивалентов хлора
Задача 235.
Определите объем 3,3 эквивалентов Cl2 (н.у.).
Решение:
Vm = 22,4 л/моль;
Молярный объем эквивалента (VmЭ или VЭ) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента рассчитаем по формуле:
VЭ = fЭ . Vm = fЭ . 22,4, где
1/[n(Э) . В(Э)], где
n(Э) – число атомов элемента (индекс в химической формуле), В(Э) – валентность элемента.
fЭ(Cl2) = 1/(2 . 1) = 1/2;
VЭ(Cl2) = fЭ . Vm = 1/2 . 22,4 = 11,2 л/моль.
Зная количество эквивалентов хлора [nfЭ(Cl2) = 3,3] и VЭ(Cl2), рассчитаем его объем, получим:
V(Cl2) = nfЭ(Cl2) . VЭ(Cl2) = 3,3(1/2) . 22,4 = 36,96 л.
Рассчет молярной массы эквивалента металла, образующегося при реакции с соляной кислотой
Задача 236.
Рассчитайте молярную массу эквивалента металла и определите какой это металл, если при взаимодействии 1 г его с разбавленной соляной кислотой выделяется водород объемом 220 мл, измеренный при давлении 740 мм. рт. ст. и температуре 21 o С. Каков фактор эквивалентности данного метала?
Решение:
Ввычислим объем водорода при нормальных условиях, используя формулу Клапейрона-Менделеева:
Vo = PVTo/PoТ = (740 . 0,22 . 273)/(760 . 294) = 0,1989 л.
Рассчитаем количество эквивалентов водорода, получим:
nfЭ(Н2) = V/VЭ(Н2) = 0,1989/11,2 = 0,01776 мольэкв.
Согласно закону эквивалентов следует, вещества реагируют в эквивалентных количествах, то число эквивалентов (молей эквивалентов) металла столько же, т.е. nfЭ(Me) = 0,01776 мольэкв. Следовательно, 1 г металла составляет 0,01776 мольэкв.
Тогда
Вычислим молярную массу эквивалента металла, получим:
МЭ(Ме) = m(Ме)/nfЭ(Me) = 1/0,0178 = 56,306 г/моль.