гипоперфузия головного мозга у ребенка
Визуализация перфузии головного мозга у новорожденных. Часть вторая
3.2.3. Ультразвук с контрастным усилением (CEUS)
CEUS направлен на повышение внутрисосудистой эхогенности путем введения контрастного вещества для ультразвука: газовых микропузырьков, заключенных в фосфолипидную мембрану, которые сжимаются и расширяются нелинейным образом под воздействием ультразвукового луча. Результирующий усиленный эхо-сигнал создает внутрисосудистый контраст, в принципе похожий на изображение поперечного сечения с использованием внутрисосудистых контрастных агентов (рис. 7).
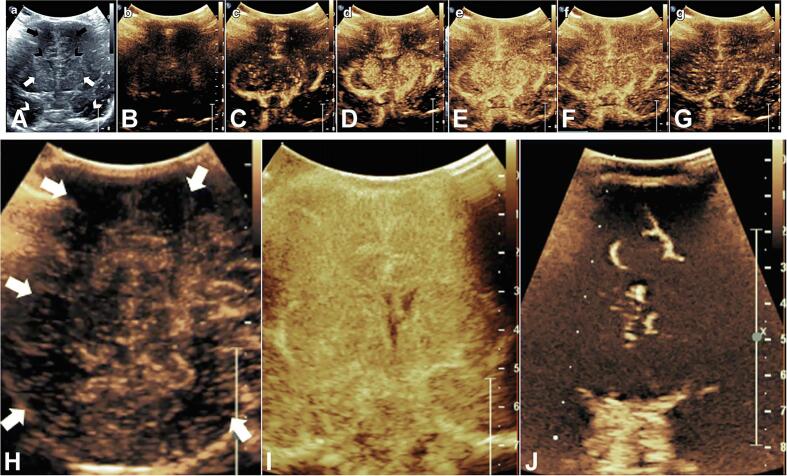
Рисунок 7 : Ультразвук с контрастным усилением (CEUS). A: Средне-корональное изображение в b-режиме, показывающее двусторонние лобные доли (черные стрелки), лобные рога боковых желудочков (черные шевроны), базальные ганглии (белые стрелки) и височные доли (белые шевроны). B-G: Статические изображения динамического вливания микропузырьков на среднекорональных изображениях здорового новорожденного. H: Задний теменно-затылочный вид новорожденного с гипоксически-ишемическим повреждением, показывающий диффузную гипоперфузию с множеством участков с малым количеством микропузырьков (белые стрелки), отражающие нарушения перфузии. I: Корональный вид через базальные ганглии у новорожденного с диффузным гипоксически-ишемическим повреждением в период сразу после травмы, демонстрирующий диффузную гиперперфузию. J: Коронарное изображение базальных ганглиев у младенца после продолжительной остановки сердца, демонстрирующее диффузную гипоперфузию. Изображение адаптировано и использовано с разрешения Hwang.
Использование CEUS у новорожденных было ограничено. Хотя до 2016 года это считалось противопоказанием для пациентов с сердечным шунтом, контрастные вещества для ультразвуковых исследований за прошедшие годы доказали свою безопасность и эффективность (Appis et al., 2015). Использование контрастных агентов для УЗИ по-прежнему не рекомендовано для ультразвукового исследования головного мозга и требует согласия родителей. CEUS может быть лучше МРТ с точки зрения необходимой инфраструктуры, доставки контрастного вещества и затрат. Однако в настоящее время имеется мало данных, подтверждающих рутинное использование ультразвукового контраста для визуализации головного мозга новорожденных (Hwang, 2019).
3.2.4. Сверхбыстрая ультразвуковая визуализация (UUI)
За последние два десятилетия в ультразвуковой визуализации произошел крупный прорыв с появлением новых технологий, таких как UUI. Хотя лежащая в основе акустическая физика такая же, как и в обычном ультразвуке, ранее описанном в этой работе, прогресс в электронике и вычислительной технике позволил использовать плоские или расходящиеся волны.
ПРАВИЛЬНО ЛИ ВЫ УХАЖИВАЕТЕ ЗА УЗ-АППАРАТОМ?
Скачайте руководство по уходу прямо сейчас
Эти несфокусированные волны позволяют реконструировать изображение с помощью одного излучения. Следовательно, модальность может достигать частоты кадров до 10 000 изображений в секунду. За счет объединения нескольких волн разной ориентации пространственное разрешение эквивалентно обычному ультразвуку (до 50 мкм) (Tanter and Fink, 2014).
Сочетание этой высокой частоты кадров и высокого пространственно-временного разрешения позволяет использовать передовые стратегии обработки сигналов для изображения потоков крови в крупных артериях, а также более медленных потоков в микрососудах (со скоростью до 1 мм / с), что приводит к сверхбыстрому допплеровскому сканированию.
Этот метод особенно хорошо подходит для новорожденных, так как ультразвук может проникать глубоко в мозг (до 8 см) через родничок и проводиться у постели больного. Как и в случае с обычным ультразвуком, UUI не инвазивен и не требует ионизирующего излучения. Посредством усреднения сверхбыстрых изображений Power Doppler в течение одного сердечного цикла, карты васкуляризации мозга с высоким разрешением были получены Демене и др. С использованием линейного датчика (рис. 8, A, B, C). Секторные изображения были получены с использованием датчика с фазированной решеткой некоторыми авторами этой работы (JB, OV, JA) в больнице для больных детей, Торонто, Канада (рис. 8D).
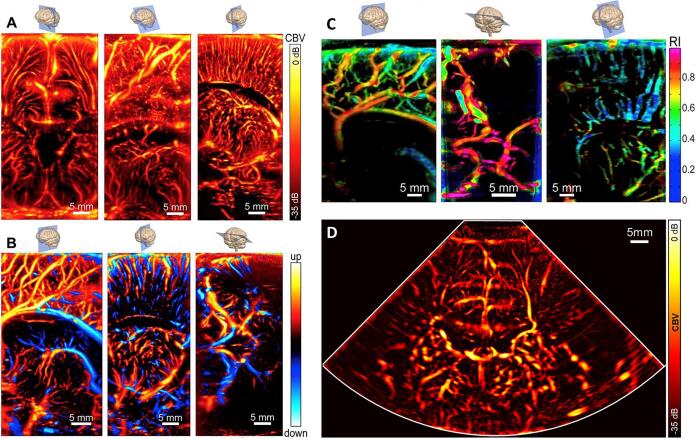
Рисунок 8 : Сверхбыстрая ультразвуковая визуализация (UUI). Трансфонтанеллярные сверхбыстрые доплеровские изображения мозга новорожденного в разных ракурсах. A: Слева направо, коронарный, наклонный парасагиттальный и парасагиттальный виды. Цветовая шкала отображает CBV с использованием функции ультразвукового допплера. B: слева направо, сагиттальные, парасагиттальные и трансвисочные осевые виды. Изображения Power-Doppler включают информацию о направлении (красный: поток к датчику, синий: поток от датчика). Видимые структуры включают периклозальную артерию, вены ниже желудочков головного мозга, корковые проникающие артериолы и венулы, а также виллизиев круг. C: Сосудистые зоны интереса, отображенные в сагиттальной, аксиальной и парасагиттальной проекциях. (A, B и C). D: Секторное сверхбыстрое допплеровское изображение, полученное в корональной проекции.
В рамках одного и того же сбора данных также можно количественно оценить кровоток в любой интересующей области с точки зрения CBV и скорости потока. Как и в обычном доплеровском режиме, измерения CBV выражаются в относительных единицах. Таким образом, сверхбыстрый допплер объединяет традиционный цветной допплер и импульсно-волновой допплер в единую модальность.
Анализируя изменения потока во время сердечного цикла, можно оценить и нанести на карту сосудистое сопротивление каждого сосуда(рис. 8C). Первые клинические применения выявили потенциал этого метода в изучении перфузии головного мозга новорожденных во время гипотермии у новорожденных. Анализ изменений кровотока во время сердечного цикла также позволяет дифференцировать артериальный и венозный кровоток на основе их разного сопротивления.
Сверхбыстрая допплерография – многообещающий метод прикроватного мониторинга. При повторном получении изображений перфузии головного мозга также можно наблюдать нервно-сосудистую связь. Первое применение этого так называемого функционального ультразвукового метода позволило по-новому взглянуть на сложную подкорковую и корковую гемодинамику во время эпилептиформных припадков.
Наблюдаемые спонтанные колебания CBV также оказываются разными в таламической и корковой областях у недоношенных и родившихся в контрольной группе новорожденных.
3.3. Компьютерная томография (КТ)
КТ-перфузия – это динамическое получение последовательных КТ-срезов после внутривенного введения болюса йодированного контрастного вещества (Proisy et al., 2016).
Режим непрерывного сканирования (режим кино) используется для отслеживания прохождения болюса контраста через сосудистую сеть головного мозга, в то время как усиление контраста ткани изображается кривой затухания с временным разрешением. КТ-перфузия может обеспечить точную оценку регионального мозгового кровотока (CBF), объема (CBV) и среднего времени прохождения (Krishnan et al., 2017). Карты CBF, CBV и среднего времени прохождения интерпретируются с помощью программного обеспечения для постобработки для визуальной оценки и количественного анализа.
У новорожденных меньший размер мозга и более высокая скорость кровотока являются биологическими препятствиями, которые препятствуют осуществлению перфузии КТ в этой возрастной группе. Кроме того, перфузия при КТ у детей затруднена из-за более высокой частоты артефактов движения, использования небольших внутривенных катетеров, которые ограничивают скорость инъекции и увеличивают время инъекции, и, что наиболее важно, из-за ионизирующего излучения, которое обычно требует дополнительных 1,57 – 2,96 мЗв для компьютерная томография перфузии. Анализ риска и пользы ионизирующего излучения при КТ-перфузии предполагает, что его применение у детей очень ограничено (Raybaud and Barkovich, 2012).
Очень немногие КТ-исследования перфузии включали новорожденных. Wintermark et al. Оценили использование перфузии КТ в условиях неотложной помощи (Wintermark et al., 2005) и определили возрастные вариации количественных значений перфузии при КТ у 77 детей в возрасте от 7 дней до 18 лет, включая 10 пациентов моложе 12 месяцев (рис. 9). Значения перфузии при КТ соответствовали другим методам визуализации и показали возрастные вариации с пиком перфузии в возрасте около 3 лет.
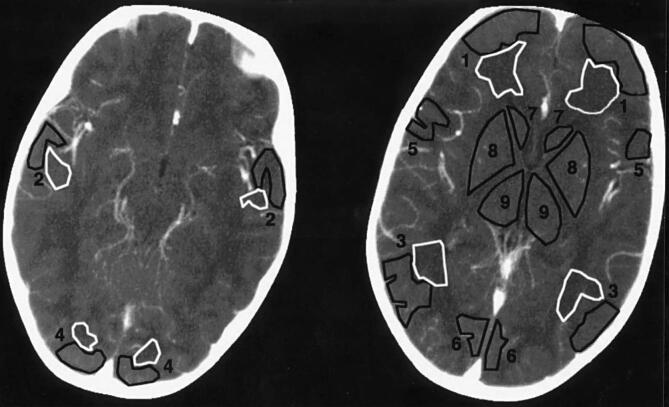
Рисунок 9 : Компьютерная томография (КТ) перфузии. Размещение областей интереса (ROI) для анализа регионального объема церебральной крови и кровотока в сером (черные области интереса) и белом (белые области интереса) веществах.
3.4. Спектроскопия в ближнем инфракрасном диапазоне (NIRS)
NIRS – это неинвазивный метод визуализации, который использует различные свойства оптического поглощения биологических структур. Биологическая ткань относительно прозрачна для ближнего инфракрасного света в так называемом оптическом окне с длинами волн от 650 до 1350 нм (Smith et al., 2009). В этом же окне всасывание крови сильно зависит от концентрации оксигемоглобина и дезоксигемоглобина (Mohammadi-Nejad et al., 2018).
При излучении ближнего инфракрасного света в ткани головного мозга через неповрежденный череп фотоны могут проникать в ткани на расстояние нескольких сантиметров. Из-за многократного рассеяния часть этого света достигает кожи головы в удаленной от излучателя точке, где ее можно обнаружить (рис. 10). Следуя закону Бера-Ламберта, динамические изменения абсорбции могут быть связаны с изменениями оксигемоглобина и дезоксигемоглобина. На основе этих концентраций NIRS обеспечивает анализ локальных изменений объема крови, а также потребления кислорода.
Клинически NIRS использовался в реанимации для непрерывного неинвазивного мониторинга региональной мозговой сатурации оксигенации, что позволяет принимать диагностические и терапевтические решения (Claessens et al., 2019, Garvey and Dempsey, 2018). Одним из преимуществ использования NIRS является его простота и портативность, заключающаяся в размещении оптических датчиков или «оптодов» на коже новорожденного у постели больного, что возможно с учетом тонкой кости черепа и относительного отсутствия волос.

Рисунок 10 : A – Принципы ближней инфракрасной спектроскопии (NIRS). Оптод пропускает инфракрасный свет через кожу головы и череп, ткани, которые имеют ограниченное поглощение на этих длинах волн. Приемный оптод собирает рассеянный свет. Адаптировано с разрешения Mohammadi-Nejad et al. (Mohammadi-Nejad et al., 2018). B – Динамические изменения абсорбции могут быть связаны с концентрацией окси- и дезоксигемоглобина [HbO] и [HbR], обладающих различными характеристиками абсорбции, из которых затем определяются изменение объема церебральной крови и оксиметрия. [HbT] – общая концентрация гемоглобина.
Сочетание мониторинга церебральной оксигенации с артериальным давлением – это неинвазивный метод, который непрерывно оценивает церебральную ауторегуляцию и дает возможность поддерживать стабильную церебральную перфузию и оксигенацию во время колебаний артериального давления (Claessens et al., 2019).
Недоношенные новорожденные, младенцы, перенесшие кардиохирургические операции по поводу критического врожденного порока сердца, а также дети, которым требуется экстракорпоральная мембранная оксигенация, подвержены риску приобретенного повреждения головного мозга из-за измененной гемодинамики, кровотечений и / или эмболических явлений. Непрерывный нейромониторинг изменений в гемодинамическом статусе чрезвычайно важен для этих новорожденных в попытке выявить тех, кто подвержен более высокому риску травмы головного мозга на ранней стадии.
Было показано, что NIRS является ценным инструментом для непрерывного мониторинга церебральной оксигенации, особенно для недоношенных детей (Hyttel-Sorensen et al., 2015) и для новорожденных, перенесших кардиохирургические операции (Hirsch et al., 2009).
Его временное разрешение превосходно (≈ 10 мс) по сравнению с МРТ или нуклеарной визуализацией. Он также изучается как многообещающий метод мониторинга эпилепсии (Wallois et al., 2010). Кроме того, функциональный NIRS – это развивающийся метод нейровизуализации, способный оценить нервно-сосудистую связь. Дальнейшие улучшения включают разработку матриц оптодов высокой плотности (HD) для улучшения пространственного разрешения, что привело к появлению диффузной оптической томографии HD (Singh et al., 2014).
Главный недостаток – плохое пространственное разрешение, поскольку путь света через ткань по сути неизвестен. Исследование глубоких структур также представляет проблему для NIRS из-за ограниченного проникновения.
Подходы ядерной медицины с использованием либо однофотонной эмиссионной томографии (ОФЭКТ), либо позитронно-эмиссионной томографии (ПЭТ) были разработаны для визуализации различных физиологических и биохимических процессов в развивающемся мозге.
В то время как ПЭТ и ОФЭКТ использовались для измерения биохимических процессов у детей с нарушениями развития, ПЭТ также применялась к новорожденным. Новорожденных с различными типами черепно-мозговых травм, включая перинатальную гипоксию-ишемию и внутрижелудочковое кровоизлияние, оценивали с помощью ПЭТ (Doyle et al., 1983), и было показано, что низкий метаболизм глюкозы связан либо со снижением кровотока, либо с задержкой развития (Suhonen-Polvi). и др., 1993).
Было обнаружено, что результаты ПЭТ в течение первых трех недель жизни коррелируют с интегрированной по амплитуде ЭЭГ и позволяют прогнозировать исход развития нервной системы после перинатальной асфиксии (Thorngren-Jerneck et al., 2001) (рис. 11).
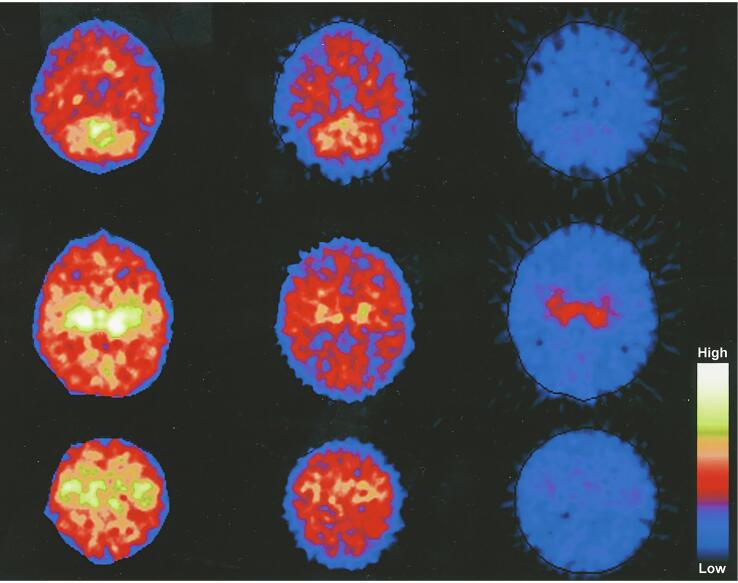
Рисунок 11 : Позитронно-эмиссионная томография (ПЭТ). Скорость церебрального метаболизма глюкозы измеряется в подостром периоде (10-11 дней) после перинатальной асфиксии у трех детей (по одному на столбец) с разной степенью гипоксически-ишемической энцефалопатии и отображается на уровне мозжечка (верхний ряд), таламуса. (средний ряд) и сенсомоторной коры (нижний ряд). У новорожденного справа развился церебральный паралич с осложненными припадками. Новорожденный слева был здоровым при двухлетнем наблюдении. Адаптировано с разрешения Thorngren-Jerneck et al.
Как правило, роль ядерной визуализации, включая ПЭТ и ОФЭКТ, у новорожденных очень ограничена, учитывая естественное воздействие ионизирующего излучения. Несмотря на то, что она все еще считается относительно низкой, расчетный эквивалент эффективной дозы на все тело в исследованиях, проведенных Thorngren-Jerneck et al. составил 0,16–0,17 мЗв / МБк. Если принять стандартный вес новорожденного 3,5 кг (IRCP, 2002) и следовать руководящим принципам введения радиофармпрепаратов на основе веса (Treves et al., 2016), расчетная введенная активность составит 14 МБк, что приведет к эффективной дозе примерно 2,4 мЗв.
Текущие ограничения и перспективы неонатальной визуализации головного мозга
Хроническая недостаточность мозгового кровообращения
Хроническая недостаточность мозгового кровообращения — медленно прогрессирующая дисфункция мозга, возникшая вследствие общего и/или мелкоочагового повреждения мозговой ткани на фоне длительно существующей недостаточности мозгового кровоснабжения.
Синонимы:
Наиболее широко в отечественную неврологическую практику вошёл термин «дисциркуляторная энцефалопатия», сохраняющий своё значение и на сегодняшний день.
Причины хронической недостаточности мозгового кровообращения:
Основные:
Дополнительные:
Для адекватной работы мозга необходим высокий уровень кровоснабжения. Головной мозг, масса которого составляет 2,0-2,5% массы тела, потребляет 20% циркулирующей в организме крови. Величина мозгового кровотока в полушариях составляет 50 мл на 100 грамм в минуту, потребление глюкозы составляет 30 мкмоль на 100 грамм в минуту, а в сером веществе эти величины в 3-4 раза выше, чем в белом. В условиях покоя потребление мозгом кислорода составляет 4 мл на 100 грамм в минуту, что соответствует 20% всего кислорода, поступающего в организм. С возрастом и при наличии патологических изменений величина мозгового кровотока снижается, что играет решающую роль в развитии и нарастании хронической недостаточности мозгового кровообращения.
Наличие головной боли, головокружения, снижения памяти, нарушения сна, появление шума в голове, звона в ушах, нечёткости зрения, общей слабости, повышенной утомляемости, снижения работоспособности и эмоциональной лабильности – эти симптомы чаще всего просто «информируют» человека об усталости. Только при подтверждении сосудистого генеза «астенического синдрома» и выявлении очаговой неврологической симптоматики устанавливают диагноз «дисциркуляторная энцефалопатия».
Основой клинической картины дисциркуляторной энцефалопатии в настоящее время признаны когнитивные (познавательные) нарушения. При хроническом нарушении мозгового кровообращения следует отметить обратную зависимость между наличием жалоб, особенно отражающих способность к познавательной деятельности (память, внимание), и степенью выраженности хронической недостаточности: чем больше страдают когнитивные (познавательные) функции, тем меньше жалоб. Параллельно развиваются эмоциональные расстройства (эмоциональная лабильность, инертность, отсутствие эмоциональной реакции, потеря интересов), разнообразные «двигательные нарушения» (расстройства ходьбы и равновесия).
Неврологические синдромы при дисциркуляторной энцефалопатии:
— паркинсонический синдром характерен замедленными движениями, гипомимией, негрубой мышечной ригидностью, тремор отсутствует, нарушения походки характеризуются замедлением скорости ходьбы, уменьшением длины шага, «скользящим», шаркающим шагом, мелким и быстрым топтанием на месте, поворачиванием всем корпусом с нарушением равновесия, что иногда сопровождается падением. При хронической недостаточности мозгового кровообращения двигательные нарушения проявляются, прежде всего, расстройствами ходьбы и равновесия;
— психоорганический синдром может проявляться эмоционально-аффективными расстройствами (астено- депрессивными и тревожно-депрессивными), когнитивными (познавательными) нарушениями;
В основе всех синдромов, свойственных дисциркуляторной энцефалопатии, лежит разобщение внутримозговых связей вследствие диффузного повреждения белого вещества мозга.
Гипоперфузия головного мозга у ребенка
Мозговой кровоток (МК; перфузиямозгового вещества) тесно связан схарактером выполняемых головныммозгом (ГМ) функций и интенсивностью его деятельности. Адекватноевыполнение определенной работы требует поступления к ГМ достаточногоколичества кислорода и энергетических субстратов, в первую очередь глюкозы. В нормальных условиях поддержание доставки должного количествакрови, соответственно энергетическихсубстратов и кислорода, обеспечивается сложными механизмами регуляциимозгового кровообращения, благодарякоторым регулируется как поступлениекрови к ГМ в целом (тотальный МК),так и его перераспределение междузонами мозга, принимающими илине принимающими в данный моментучастия в реализации определенныхфункций (локальный или региональный кровоток). Взаимозависимостьфункций ГМ и МК подробно изучаласькак отечественными, так и зарубежными исследователями (Демченко И.Т.,Москаленко Ю.Е., Мчедлишвили Г.И.,Lassen N., Strandgaard N).
Существуют сложные взаимоотношения между состоянием мозговоговещества и уровнем его перфузии.Активация определенных областеймозга, сопровождающаяся увеличением энергетических потребностей,вызывает повышение их перфузии, инапротив, менее интенсивной работецеребральных структур соответствует менее высокий уровень кровотока.Однако не всегда наблюдается полноесоответствие уровня кровотока структурному состоянию мозгового вещества (выраженности атрофии) и интенсивности церебрального метаболизма.При различных патологических процессах, особенно на ранних стадияхразвития заболевания, возможно сочетание зон высокого и низкого кровотока, участков повышенного и сниженного метаболизма. Уменьшение кровотока может быть до определеннойстепени компенсировано повышениемкстракции кислорода и глюкозы [11].Ограничение поступления крови кГМ (олигемия, церебральная гипоперфузия – ЦГ), не достигающее критического уровня, вызывающего ишемический некроз ткани (инфаркт),ведет к нарушению метаболизма, чтоможет компенсироваться повышением экстракции кислорода и глюкозыиз крови. Возникающие при этомфункциональные нарушения могутприводить к включению сложных
механизмов отсроченного повреждения вещества ГМ [5]. Уровень кровотока, при котором инициируютсяэти процессы, может варьироваться в зависимости от локализации областинарушенного кровотока, преимущественной гипоперфузии в белом илисером веществе, индивидуальных, вт. ч. генетически детерминированных, особенностей обмена веществ,некоторых других факторов.
Как правило, имеется соответствие выраженности и локализацииатрофических изменений и локального снижения кровотока. Вместе стем нормальный уровень кровотокаможет наблюдаться в областях мозга свыраженными атрофическими измествия между выраженностью атрофиимозгового вещества по результатаммагнитно-резонансной томографии(МРТ) и состояния кровотока разнообразны. Так, при различных типахдеменции могут страдать отдельныеучастки мозга при достаточно длительной сохранности других его отделов. При различных патологическихпроцессах клетки мозга могут подвергаться атрофии в разной степени;например, на фоне гибели части клеток глии при относительной сохранности нейронов и их связей функциимозга могут оставаться интактными,кровоток – высоким [7]. С другойстороны, снижение кровотока, соответствующее выраженности атрофии,может быть связано с уменьшениемпотребности тканей в кислороде, атакже нарушением функций оставшихся клеток.
Причины развития ЦГ
Причины возникновения ЦГ разнообразны и включают как непосредственное поражение артерий, кровоснабжающих ГМ, так и нарушениемеханизмов, поддерживающих постоянство притока крови к мозгу в условиях нестабильности системного артериального давления (АД).
С учетом того, что основная массабелого вещества больших полушарий получает кровь из артерий малого калибра, представляется очевиднойроль микроангиопатий в развитииЦГ. Поражение белого вещества тесноассоциировано с развитием когнитивных нарушений. Одной из основныхпричин поражения белого веществаявляется артериальная гипертензия(АГ), причем выраженность поражения мозгового вещества определяетсяуровнем АД, длительностью АГ и некоторыми другими факторами [12, 24].
Основной причиной поражения артерий малого калибра являются АГ и сахарный диабет (СД). Сосуществование двух заболеваний взначительной степени ускоряет развитие сосудистого поражения головного мозга. Результаты исследований,проведенных при помощи однофотонной эмиссионной компьютернойтомографии, свидетельствуют о том,что у больных СД типа 2 (СД2) регистрируется снижение как общего, таки регионарного МК примерно на 30 %[27]. Сходные данные о сниженииутилизации глюкозы мозговой тканью (гипометаболизм, соответствующий гипоперфузии) были выявленыпри использовании позитронно-эмиссионной томографии у больныхСД2 [35].
Следует, однако, подчеркнуть, чтосуществование прямой связи междуналичием СД2, уровнем гликемии,состоянием когнитивных функций иинтенсивностью МК было подтверждено не всеми исследователями [49].Отсутствие линейной зависимостимежду указанными показателями свидетельствует об исключительной сложности взаимоотношений МК и функций ГМ, существовании многочисленных факторов, влияющих на характерэтих взаимоотношений. Характер иинтенсивность изменений локальногоМК у больных СД2 в значительнойстепени определяются выраженностьюатрофических изменений веществабольших полушарий ГМ [45].
Важной причиной формированияЦГ является атеросклеротическое стенозирующее поражение магистральных артерий головы, в первую очередь внутренних сонных артерий (СА).В условиях экспериментального сужения (частичной перевязки) одной изСА у животных снижение кровотока
регистрируется как в сером, так и вбелом веществе соответствующегополушария, однако в большей степени страдает именно белое вещество[47]. Значимость указанного факторавозрастает при нарушении возможности обеспечения коллатерального кровоснабжения через сосуды виллизиевакруга, пиальные артерии. Результатынейропсихологического тестированиясвидетельствуют о наличии прогрессирующих нарушений высших мозговыхфункций, обусловленных поражением полушария, гомолатерального поотношению к стороне гемодинамически значимого стеноза внутренней СА[26]. Когнитивное снижение, особенно характерное для поражения сосуда, кровоснабжающего доминантноеполушарие, наблюдается даже у больных с асимптомным стенозом внутренней СА [23].
Причиной развития ЦГ могут бытьсостояния, характеризующиеся низкимсердечным выбросом, обусловленнымпатологией миокарда. Предполагаетсяучастие в развитии ЦГ и других механизмов регуляции системного и регионального кровообращения, нарушенных у больных ишемической болезньюсердца (ИБС), застойной сердечнойнедостаточностью [19]. Вероятностьразвития ЦГ и, соответственно, когнитивных нарушений возрастает упациентов с нарушениями системнойгемодинамики, в частности артериальной гипотензией, обусловленнойтяжелыми нарушениями сердечногоритма и проводимости (полной поперечной блокадой) [43]. Получены данные о том, что значительное снижениесердечного выброса и соответствующее ему снижение МК ассоциированы с нарушением исполнительныхфункций [20].
Вероятно, это может быть связанос поражением белого вещества, прилежащего к подкорковым ядрам, обеспечивающим функционированиефронто-субкортикальных связей [15].Примечательно, что у пациентов с низким сердечным выбросом преимущественно страдает подкорковое, а неперивентрикулярное белое вещество.Важной причиной ЦГ является неадекватно низкий уровень АД, в частности, обусловленный избыточнымприменением антигипертензивныхпрепаратов. У определенных групппациентов, нуждающихся в антигипертензивной терапии, ее проведениетребует особой осторожности в отношении предупреждения артериальнойгипотензии. К ним относятся больныес двусторонним гемодинамически значимым стенозом внутренних СА, лицав возрасте старше 75 лет, некоторымидругими патологическими состояниями. Избыточное снижение системногоАД у лиц старческого возраста (систолическое давление – менее 110 мм рт. ст.)не только не снижает риска развитиякогнитивных нарушений, как это былопродемонстрировано в исследованииHYVET-COG [31], но и может бытьассоциировано с повышенным рискомразвития деменции [18].
Непременным условием формирования в этих условиях ЦГ являетсянарушение функционирования ауторегуляции мозгового кровообращения,эффективность которой снижается свозрастом, при наличии АГ, эндотелиальной дисфункции, некоторых другихпатологических состояний, пораженийцеребральных артерий мелкого калибра [20].
Значимым фактором возникновения ЦГ с последующим развитиемкогнитивных нарушений являетсявсевозрастающее число оперативныхвмешательств, проводимых в условиях искусственного кровообращения[1]. Совершенствование анестезиологической помощи таким пациентам,обеспечение современных методовподдержания адекватной системнойгемодинамики несомненно способнывести к уменьшению частоты случаев интраоперационной церебральнойишемии. Вместе с тем риск развитиягипоперфузии остается высоким упациентов, нуждающихся в хирургическом лечении по поводу ИБС, со стенозирующим поражением магистральных артерий головы, в первую очередь внутренних СА. Так, при анализерезультатов 4047 случаев реваскуляризации миокарда было установлено, что частота периоперационного инсульта у пациентов с изолированной ИБС составила 1,9 %, тогда как при сопутствующем стенозирующем поражении СА она возросла до 9,2 % [10].
Возникновение ЦГ способно вестине только к поражению белого вещества, но и к вовлечению в патологический процесс коры больших полушарий, расположенной в зонах водоразделов – на границе территорий, кровоснабжающихся основными интракраниальными артериями. Низкий
уровень системного АД может вести кзначительному снижению кровотокав этих областях, что в итоге приводитк возникновению билатеральных мелких очагов инфаркта в коре большихполушарий [6]. Особенно уязвимыми являются передние отделы лобныхдолей и теменно-затылочные области.Малые корковые инфаркты, обусловленные дефицитом кровообращенияв зонах смежного кровообращения,характеризуются изменениями преимущественно в коре больших полушарий, проявляясь зонами гранулярнойатрофии коры, которые распространяются от полюса лобных долей к вертексу, достигают затылочных долей,нередко вовлекая медиальные отделаполушарий [44].
Пути, по которым развиваетсяповреждение вещества ГМ в условияхЦГ, многообразны и, как и в другихситуациях ишемии, не могут быть сведены исключительно к острому ишемическому некрозу (инфаркту) и/илиапоптозу. Регистрируется преимущественное поражение белого вещества в
виде демиелинизации, гибели аксоновклеток, со временем нарастающих вобъеме очагов глиоза с последующейгибелью нейронов. В целом именностепень и длительность ЦГ определяютвыраженность неврологического дефицита и темпы его прогрессирования,однако в реализации повреждающегодействия ишемии принимает участияряд факторов: активация микроглии иматриксных металлопротеиназ, нарушение целостности гематоэнцефалического барьера, гибель олигодендроцитов [33, 40, 48]. Различные клеткихарактеризуются неодинаковой чувствительностью к ишемии; в большейстепени уязвимыми являются холинергические нейроны [36]. В итоге серииуказанных событий мозговое веществогибнет, что может быть выявлено нетолько при морфологическом, но ипри нейровизаулизационном исследовании. Считается, что наблюдаемыепри анализе МРТ-изображений атрофия коры больших полушарий, явления лейкоареоза, коррелирующие снарушением когнитивных функций,являются следствием ЦГ [29].
ЦГ и когнитивные нарушения
В Международной классификацииболезней 10-го пересмотра термин“гипоперфузионная деменция” отсутствует. Хотя есть основания полагать,что развитие когнитивного снижения,обусловленного сосудистым поражением ГМ, связано именно с состоянием ЦГ. Продемонстрировано развитиесосудистых умеренных когнитивныхнарушений у пациентов со сниженнымМК [8]. Установлено, что именно утаких больных в последующем наблюдается максимальный риск развитиятяжелой деменции и инвалидизации.
Серьезную проблему представляет собой постинсультная деменция, развивающаяся у значительногочисла пациентов, перенесших мозговой инсульт. Считается, что локальное снижение МК у лиц, перенесшихинсульт, запускающее сложную последовательность патологических процессов, лежит в ее основе [13]. Важнуюроль играет локализация очага поражения, о чем свидетельствует, например,острое начало деменции при перенесенном инсульте в “стратегических”зонах мозга. Особенности клиническихпроявлений когнитивных нарушений взначительной степени определяютсялокализацией областей нарушенного кровотока (в частности, корковые,подкорковые), выраженностью ЦГ,
факторами, определяющими выживаемость нервной ткани в условиях неблагоприятного воздействия (ишемии) ивозможности течения репаративныхпроцессов. В определенной степенивыраженность и клинические особенности имеющегося когнитивногодефицита (или в развернутой стадиизаболевания – деменции) ассоциированы с локализацией и обширностьюзон гипоперфузии [9].
Интерес представляют данные о том,что ЦГ может быть ассоциированной нетолько с развитием сосудистой деменции, но и с болезнью Альцгеймера(БА). Результаты экспериментов,проведенных на модели животных,показали, что значительное снижениеМК вызывает поражение капилляровв виде дегенерации их стенок, ещеболее ухудшающее доставку кислорода и глюкозы к мозгу [16]. Важнойсоставляющей патологического процесса, объединяющего нейродегенеративное и ишемическое поражениеГМ, является нарушение целостностигематоэнцефалического барьера [14].Считается, что дефицит кислорода иглюкозы создает условия для реализации и/или прогрессирования истинного нейродегенеративного процесса.При помощи оригинальной разработанной нейровизуализационной системы, позволяющей получать совмещенное диффузионно-взвешенное иструктурное изображение, были выявлены зоны сниженного кровотока какв сером, так и белом веществе большихполушарий ГМ [46].
Вероятность развития БА илисмешанной деменции выше у лиц сизвестными имеющимися факторамисердечно-сосудистого риска (АГ, СД,стенозирующее поражение магистральных артерий головы), а также при ихсочетании. Вместе с тем установлено,что у значительного числа пациентовс БА в отсутствие гемодинамическизначимых стенозов СА и признаковгипертонической микроангиопатиивыявляются очаги малых инфарктовв коре больших полушарий, преимущественно в зонах водоразделов. Естьвсе основания полагать, что они являются следствием гипоперфузии, обусловленной эпизодами снижения АД[44]. Интересно, что именно в нижней зоне смежного кровообращения(зубчатой извилине, трансэнторинальной коре, субикулуме) регистрируетсямаксимальная плотность сенильныхбляшек у пациентов с заболеваниямисердечно-сосудистой системы по сравнению с контрольной группой [42].
Характерным для пациентов с БАявляется снижение как локальногокровотока, так и интенсивности энергетического метаболизма (определяли по уровню утилизации глюкозы при помощи позитронно-эмиссионной томографии) в теменно-височной коре, задних отделах поясной извилины. Указанные изменения регистрируются не только у пациентов с развернутой картиной заболевания, но и у больных с умеренными когнитивными нарушениями, а также у членов семейс наследственной формой БА до развития когнитивных нарушений [23].
В целом локальное снижение МКчасто наблюдается как при БА, так и присосудистой деменции, причем, согласно результатам некоторых исследований, частота обнаруженных нарушений может быть выше при первичномнейродегенеративном процессе [30].Вместе с тем причинно-следственнаясвязь нарушения церебральных функций и кровотока представляется далеконе всегда очевидной. В ряде случаев прикогнитивных нарушениях сосудистогогенеза нарушение поступления кислорода и глюкозы к отдельным областямГМ вызывает гибель или дисфункциюнейронов, являясь причиной формирования неврологического дефицита.С другой стороны, при некоторых патологических состояниях, не связанныхс первичным поражением сосудистогорусла (нейродегенерация, демиелинизирующие процессы), наблюдается нетолько уменьшение локального кровотока, но и снижение экстракции кислорода, а также глюкозы веществом мозга.Указанные изменения могут быть обусловлены гибелью части нейронов иглиальных клеток или уменьшениеминтенсивности их метаболизма, чтоприводит к снижению потреблениякислорода и энергетических субстратов. Вероятно, и эффективность лечения, направленного на восстановлениесниженного кровотока, в этих случаяхокажется различной.
Возможности коррекции сниженного кровотока
Основными направлениями леченияпациентов с когнитивными нарушениями на сегодняшний день являютсявосполнение дефицита ацетилхолинав ГМ и, вероятно, применение препаратов, оказывающих нейропротективное и/или нейротрофическое действие. Целью такой терапии является
замедление прогрессирования заболевания и уменьшение выраженностикогнитивного дефицита. Устранениефакторов сердечно-сосудистого рискаразвития сосудистой деменции можетоказать определенное защитное действие. Однако следует отметить, что вслучае уже сформировавшегося когнитивного дефицита эти меры, в т. ч. коррекция уровня АД, гликемии, способны снижать темпы прогрессированияпатологического процесса, однако,как правило, не в состоянии устранятьсуществующие нарушения.
С учетом сведений о связи ЦГ сразвитием когнитивных нарушенийдля лечения пациентов с указаннымирасстройствами возможно применятьпрепараты, обладающие сосудорасширяющим действием, улучшающиемикроциркуляцию. Целый ряд препаратов, обладающих вазодилатирующимдействием, оказывает положительноевоздействие на состояние больных скогнитивными нарушениями, причемклиническое улучшение сопровождается увеличением МК [3, 25]. Одним
из таких препаратов является Вазонит(пентоксифиллин), помимо сосудо-расширяющего действия обладающийрядом ценных эффектов. Действие препарата обусловлено угнетением активности фосфодиэстеразы, вследствиечего возрастает концентрация циклического АМФ, развивается вазодилатация и снижается периферическоесосудистое сопротивление. Вазонитспособен улучшать деформируемостьэритроцитов, что обеспечивает снижение вязкости крови и улучшает микроциркуляцию. Именно вследствие сочетанного эффекта в отношении микроциркуляции и снижения сосудистогосопротивления применение Вазонитасопровождается повышением органной перфузии и увеличением поступления кислорода в ткани.
Большой интерес представляетспособность Вазонита ингибироватьсинтез ряда провоспалительных цитокинов, в частности фактора некроза опухоли α, интерлейкинов-1 и-6, трансформирующего фактора β,интерферона-γ [32, 17]. Эти эффектыбыли выявлены не только в условияхэксперимента, но и у больных ИБС.Интересно, что снижение экспрессиипровоспалительных цитокинов сопровождалось улучшением клиническогосостояния больных [39]. Полученыданные о способности Вазонита повышать активность супероксиддисмутазы и каталазы, уменьшая тем самыминтенсивность процессов перекисного окисления при повреждениитканей [37].
Накоплен значительный опыт применения Вазонита при различных формах цереброваскулярных расстройств[4]. Опубликованы результаты клинических исследований, посвященныхизучению эффективности примененияпентоксифиллина в качестве средства,замедляющего прогрессирование сосудистой деменции [29]. Имеются определенные положительные результатыпри лечении пентоксифиллином пациентов с мультиинфарктной деменцией [34]. Систематизированный обзоррезультатов 20 исследований эффективности применения пентоксифиллина у пациентов с сосудистой деменцией в целом позволил констатироватьдостоверно большую эффективностьприменения препарата по сравнениюс плацебо [38]. Авторы отметили существенные различия в дизайне проведенных исследований, что не позволило провести корректное сопоставлениевсех имеющихся работ. На результатыисследования в значительной степениоказали влияние точность формулирования задач и выбор критериев сосудистой деменции. Максимально раннееначало лечения в отсутствие сформировавшегося выраженного когнитивного дефекта способно оказать болеезначимый положительный эффект.
В целом Вазонит характеризуетсяхорошей переносимостью; не былополучено данных о достоверном повышении риска возникновения геморрагических (в т. ч. гастроинтестинальных)осложнений терапии, а также прочихсерьезных нежелательных побочныхэффектов при его применении. Важно,что при применении Вазонита в терапевтических дозировках значимыхколебаний системного АД не наблюдалось, не было также зарегистрированоявлений внутричерепного синдромаобкрадывания.
Приведенные данные позволяютпредполагать целесообразность применения Вазонита у пациентов с когнитивными нарушениями на фонеявлений ЦГ.

