дросселирование газов и паров в чем заключается эффект джоуля томсона
Полезное
ДЖОУЛЯ-ТОМПСОНА ЭФФЕКТ — (Джоуля Келвина эффект), снижение температуры, имеющее место при выходе газа через небольшое отверстие в зону низкого давления. Это происходит потому, что при выходе газ должен противостоять межмолекулярным силам. На этом эффекте основан принцип… … Научно-технический энциклопедический словарь
ЭФФЕКТ ДЖОУЛЯ-ТОМПСОНА — ЭФФЕКТ ДЖОУЛЯ ТОМПСОНА, см. ДЖОУЛЯ ТОМПСОНА ЭФФЕКТ … Научно-технический энциклопедический словарь
эффект Джоуля — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN Joule effect … Справочник технического переводчика
СКИН-ЭФФЕКТ — (от англ. skin кожа, оболочка) (поверхностный эффект), затухание эл. магн. волн по мере их проникновения в глубь проводящей среды, в результате к рого, напр., перем. ток по сечению проводника или перем. магн. поток по сечению магнитопровода… … Физическая энциклопедия
Скин-эффект — (от англ. skin кожа, оболочка) поверхностный эффект, затухание электромагнитных волн по мере их проникновения в глубь проводящей среды, в результате которого, например, переменный ток по сечению проводника или переменный магнитный поток… … Большая советская энциклопедия
TОMCOHA ЭФФЕКТ — доп. выделение или поглощение тепла (помимо тепла, выделяемого в соответствии с законом Джоуля Ленца) при прохождении тока через проводник, в к ром имеется перепад темп ры. Кол во тепла пропорционально току и перепаду темп ры. Предсказан У.… … Естествознание. Энциклопедический словарь
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ — один из двух осн. законов термодинамики, представляет собой закон сохранения энергии для систем, в к рых существ. значение имеют тепловые процессы. П. н. т. было сформулировано в сер. 19 в. в результате работ нем. учёного Ю. Р. Майера, англ.… … Физическая энциклопедия
СССР. Естественные науки — Математика Научные исследования в области математики начали проводиться в России с 18 в., когда членами Петербургской АН стали Л. Эйлер, Д. Бернулли и другие западноевропейские учёные. По замыслу Петра I академики иностранцы… … Большая советская энциклопедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
ФИЗИКА — (от древнегреч. physis природа). Древние называли физикой любое исследование окружающего мира и явлений природы. Такое понимание термина физика сохранилось до конца 17 в. Позднее появился ряд специальных дисциплин: химия, исследующая свойства… … Энциклопедия Кольера
Электротермия — (от Электро. и греч. thérme жар, тепло) прикладная наука о процессах преобразования электрической энергии в тепловую; отрасль электротехники, осуществляющая проектирование, изготовление и эксплуатацию электротермических установок;… … Большая советская энциклопедия
Эффект Джоуля-Томсона
Эффект Джоуля-Томсона объясняется тем, что внутренняя энергия газа определяется не только хаотическим тепловым движением молекул. В реальном газе существуют и межмолекулярные силы взаимодействия, где присутствуют и притяжение, и отталкивание; соотношение между ними определяется как природой газа, так и температурой и давлением.
О силах притяжения писал Д.И. Менделеев, когда объяснял «точку абсолютного кипения» жидкостей. При дросселировании поэтому производится внутренняя работа, затрачиваемая на раздвижение молекул вопреки силам их взаимного притяжения. В результате часть энергии теплового движения молекул переходит в потенциальную энергию их взаимодействия. Соответственно температура газа понижается, хотя общая его энергия не изменяется. Происходит лишь ее перераспределение – убыль кинетической и рост потенциальной.
По существу, с аналогичным принципом перераспределения энергии связаны и два древнейших способа охлаждения испарение и использование охлаждающих смесей.
В первом случае, при испарении, от воды (или другой жидкости, например эфира) отбирается энергия, идущая на раздвижку молекул («разрыв сил их сцепления», по терминологии Д. И. Менделеева), равная теплоте парообразования. Эта энергия уносится с образовавшимся паром, а жидкость соответственно охлаждается.
Остается объяснить странное поведение водорода при дросселировании – он нагревается, а не охлаждается. Это тоже было понято значительно позже. Выяснилось, что здесь действуют те же законы реального газа, что и для воздуха, кислорода и азота. Разница лишь в том, что у водорода при температурах, с которыми работали Джоуль и Томсон, силы отталкивания, связанные со взаимодействием молекул во время их сближений при тепловом движении, играют относительно большую роль, чем силы притяжения. Поэтому перераспределение энергии происходит наоборот: потенциальная энергия взаимодействия молекул при расширении падает, а кинетическая – растет. Соответственно повышается и температура.
Ниже даны (полученные уже значительно позже) значения температур инверсии для разных газов:
| T, K | |
| Азот | 604 |
| Воздух | 650 |
| Кислород | 771 |
| Метан | 953 |
| Оксид углерода | 644 |
| Водород | 264 |
Каждый из перечисленных газов при температуре ниже инверсионной может быть охлажден путем дросселирования; при достаточно больших начальных давлениях это охлаждение может быть весьма существенным и составлять десятки градусов. Особенно эффективно дросселирование в том случае, когда через дроссель пропускается жидкость и в нем происходит испарение или сублимация. В этом случае внутренняя работа против сил притяжения молекул существенно больше. Именно таким путем Тилорье получил «сухой лед» и пар из жидкого диоксида углерода.
Для всех перечисленных газов температура инверсии намного выше температуры окружающей среды. Поэтому дросселирование как способ охлаждения применимо для них в любом низкотемпературном интервале. Только водород должен быть предварительно охлажден ниже 160K, чтобы можно было использовать его дросселирование для охлаждения.
В результате исследований свойств газов, проведенных к началу 70-х годов XIX в., были заложены основы двух новых способов охлаждения; ограничения, которые не позволили Фарадею ожижить «постоянные» газы в принципе были сняты, но это – только в принципе. Дальше мы увидим, какой трудный путь нужно было пройти, чтобы не только совершить на практике прорыв в область более низких температур (криотемператур), но и получить первые ожиженные «постоянные» газы.
Температур



Эффект Джоуля-Томсона. Сжижение газов и получение низких
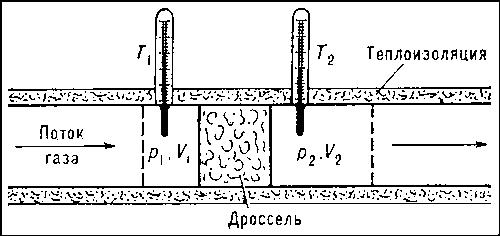
Эффект Джоуля-Томсона заключается в изменении температуры реального газа в результате адиабатного дросселирования – медленного протекания газа под действием постоянной разности давлений сквозь дроссель – пористую перегородку, представляющую препятствие газовому потоку 2. Этот эффект был обнаружен в 1852-1862 годах.
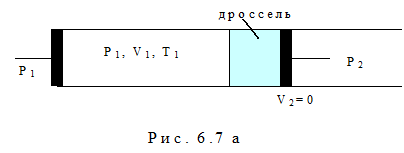
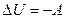
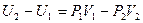
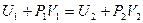
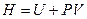
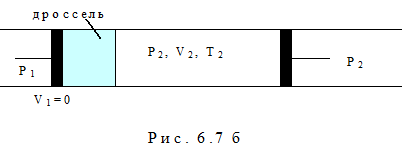
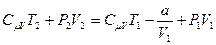
Учтём, что 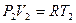
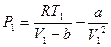
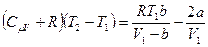
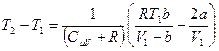
Анализируя уравнение (6.21), заметим, что знак изменения температуры при дросселировании зависит от знака выражения в скобках. Перемена знака изменения температуры происходит при температуре, называемой температурой инверсии Ti, которая соответствует выражению в скобках, равному нулю:
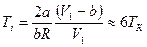
Критические температуры большинства веществ превышают 50 К. Поэтому для этих веществ температура инверсии около 300 К и их сжижение может быть получено без предварительного охлаждения. Однако для водорода (Н2) и гелия (Не) критические температуры очень низкие. Опыт Джоуля-Томсона, проведённый при температуре 300 К, показал, что эти газы нагреваются. Но при достаточном предварительном охлаждении и их удаётся перевести в жидкое состояние.
Для сжижения газов используют эффект Джоуля-Томсона, а для увеличение производительности сжижения, применяют ещё и адиабатное расширение газа с совершением работы. Сжиженные газы находятся под сравнительно низким давлением, поэтому они кипят, что вызывает дополнительное понижение температуры. Из-за интенсивного кипения сжиженные газы держат в открытых сосудах Дьюара, так как в закрытом сосуде давление сильно бы возросло, что могло бы привести к разрушению (взрыву) сосуда
Эффект Джоуля – Томсона
СОДЕРЖАНИЕ
История [ править ]
Описание [ править ]
Адиабатическое (тепло не обменены) расширение газа может быть осуществлено в нескольких формах. Изменение температуры, которое испытывает газ во время расширения, зависит не только от начального и конечного давления, но также от способа, которым осуществляется расширение.
Физический механизм [ править ]
Коэффициент Джоуля – Томсона (Кельвина) [ править ]
См. Вывод коэффициента Джоуля – Томсона ниже для доказательства этого соотношения. Значение обычно выражается в ° C / бар (единицы СИ: K / Па ) и зависит от типа газа, а также от температуры и давления газа перед расширением. Его зависимость от давления обычно составляет всего несколько процентов для давлений до 100 бар. μ J Т <\ displaystyle \ mu _ <\ mathrm
Для идеального газа он всегда равен нулю: идеальные газы ни теплые, ни холодные при расширении с постоянной энтальпией. μ J Т <\ displaystyle \ mu _ <\ mathrm
Приложения [ править ]
На практике эффект Джоуля-Томсона достигается за счет расширения газа через дросселирующее устройство (обычно клапан ), которое должно быть очень хорошо изолировано, чтобы предотвратить передачу тепла к газу или от него. Во время расширения из газа не извлекается никакая внешняя работа (например, газ не должен расширяться через турбину ).
Доказательство того, что удельная энтальпия остается постоянной [ править ]
| Викиверситет анализирует это доказательство более подробно |
В процессе Джоуля – Томсона газ изолирован, поэтому тепло не поглощается. Это означает, что
где h 1 и h 2 обозначают удельные энтальпии количества газа в областях 1 и 2 соответственно.
а) T = 300 K, p = 200 бар, s = 5,16 кДж / (кг · K), h = 430 кДж / кг; б) T = 270 K, p = 1 бар, s = 6,79 кДж / (кг · K), h = 430 кДж / кг; в) T = 133 K, p = 200 бар, s = 3,75 кДж / (кг · K), h = 150 кДж / кг; г) T = 77,2 K, p = 1 бар, s = 4,40 кДж / (кг · K), h = 150 кДж / кг; д) T = 77,2 K, p = 1 бар, s = 2,83 кДж / (кг · K), h = 28 кДж / кг (насыщенная жидкость при 1 бар); f) T = 77,2 K, p = 1 бар, s = 5,41 кДж / (кг · K), h = 230 кДж / кг (насыщенный газ при 1 бар).
Вывод коэффициента Джоуля – Томсона [ править ]
( ∂ T ∂ P ) H ( ∂ H ∂ T ) P ( ∂ P ∂ H ) T = − 1. <\displaystyle \left(<\frac <\partial T><\partial P>>\right)_ \left(<\frac <\partial P><\partial H>>\right)_ Это уравнение можно использовать для получения коэффициентов Джоуля – Томсона из более легко измеряемого изотермического коэффициента Джоуля – Томсона. Далее он используется для получения математического выражения для коэффициента Джоуля – Томсона с точки зрения объемных свойств жидкости. Чтобы продолжить, отправной точкой является фундаментальное уравнение термодинамики в терминах энтальпии; это Теперь «деление» на d P при постоянной температуре дает ( ∂ H ∂ P ) T = T ( ∂ S ∂ P ) T + V <\displaystyle \left(<\frac <\partial H><\partial P>>\right)_ ( ∂ S ∂ P ) T = − ( ∂ V ∂ T ) P = − V α <\displaystyle \left(<\frac <\partial S><\partial P>>\right)_ =-V\alpha \,> Легко проверить, что для идеального газа, определенного подходящими микроскопическими постулатами, αT = 1, поэтому изменение температуры такого идеального газа при расширении Джоуля – Томсона равно нулю. Для такого идеального газа этот теоретический результат означает, что: Внутренняя энергия фиксированной массы идеального газа зависит только от его температуры (а не от давления или объема). Адиабатическое (тепло не обменены) расширение газа может быть осуществлено в нескольких формах. Изменение температуры газа во время расширения зависит не только от начального и конечного давления, но и от того, как происходит расширение. См. Вывод коэффициента Джоуля – Томсона ниже для доказательства этого соотношения. Значение μ J Т <\ displaystyle \ mu _ <\ mathrm Для идеального газа μ J Т <\ displaystyle \ mu _ <\ mathrm На практике эффект Джоуля-Томсона достигается за счет расширения газа через дросселирующее устройство (обычно клапан ), которое должно быть очень хорошо изолировано, чтобы предотвратить передачу тепла к газу или от него. Во время расширения из газа не извлекается никакая внешняя работа (например, газ не должен расширяться через турбину ). В процессе Джоуля – Томсона газ изолирован, поэтому тепло не поглощается. Это значит, что где h 1 и h 2 обозначают удельные энтальпии количества газа в областях 1 и 2 соответственно. а) T = 300 K, p = 200 бар, s = 5,16 кДж / (кг · K), h = 430 кДж / кг; б) T = 270 K, p = 1 бар, s = 6,79 кДж / (кг · K), h = 430 кДж / кг; в) T = 133 K, p = 200 бар, s = 3,75 кДж / (кг · K), h = 150 кДж / кг; г) T = 77,2 K, p = 1 бар, s = 4,40 кДж / (кг · K), h = 150 кДж / кг; д) T = 77,2 K, p = 1 бар, s = 2,83 кДж / (кг · K), h = 28 кДж / кг (насыщенная жидкость при 1 бар); f) T = 77,2 K, p = 1 бар, s = 5,41 кДж / (кг · K), h = 230 кДж / кг (насыщенный газ при 1 бар). Сложно физически представить, что такое коэффициент Джоуля – Томсона, μ J Т <\ displaystyle \ mu _ <\ mathrm C п знак равно ( ∂ ЧАС ∂ Т ) п <\ displaystyle C _ <\ mathrm > = \ left ( <\ frac <\ partial H><\ partial T>> \ right) _ > μ Т знак равно ( ∂ ЧАС ∂ п ) Т <\ displaystyle \ mu _ <\ mathrm Последнюю величину измерить легче, чем μ J Т <\ displaystyle \ mu _ <\ mathrm Это уравнение можно использовать для получения коэффициентов Джоуля – Томсона из более легко измеряемого изотермического коэффициента Джоуля – Томсона. Далее он используется для получения математического выражения для коэффициента Джоуля – Томсона с точки зрения объемных свойств жидкости. Чтобы продолжить, отправной точкой является фундаментальное уравнение термодинамики в терминах энтальпии; это Теперь «деление» на d P при постоянной температуре дает Это выражение теперь можно заменить μ Т <\ displaystyle \ mu _ <\ mathrm Это дает выражение для коэффициента Джоуля – Томсона в терминах общеизвестных свойств: теплоемкости, молярного объема и коэффициента теплового расширения. Он показывает, что температура инверсии Джоуля – Томсона, при которой μ J Т <\ displaystyle \ mu _ <\ mathrm Легко проверить, что для идеального газа, определенного подходящими микроскопическими постулатами, αT = 1, поэтому изменение температуры такого идеального газа при расширении Джоуля – Томсона равно нулю. Для такого идеального газа этот теоретический результат означает, что: Внутренняя энергия фиксированной массы идеального газа зависит только от его температуры (а не от давления или объема).Второй закон Джоуля [ править ]
Эффект Джоуля – Томсона