что такое трепанация головного мозга
Что такое трепанация головного мозга
Костно-пластическая трепанация черепа выполняется с целью доступа в полость черепа. Показаниями для костно-пластической трепанации черепа неё являются операции по поводу опухолей и инсультов мозга, ранений сосудов твёрдой мозговой оболочки, вдавленных переломов костей черепа.
Отличие костно-пластической трепанации от резекционной заключается в том, что широкий доступ в полость черепа создаётся путём выкраивания большого костного лоскута, который после выполнения оперативного приёма укладывают на место. После такой трепанации не требуется повторной операции с целью ликвидации дефекта кости, как при резекционной трепанации (рис. 5.36).
Подковообразный разрез мягких тканей производят с таким расчетом, чтобы основание лоскута было внизу. Тогда не пересекаются идущие радиально снизу вверх сосуды и кровоснабжение лоскута мягких тканей не нарушается. Длина основания лоскута не менее 6-7 см. После остановки кровотечения кожно-мышечно-апоневротический лоскут отворачивают книзу на марлевые салфетки и сверху прикрывают марлей, смоченной изотоническим раствором хлорида натрия или 3 % раствором перекиси водорода.
Выкраивание костно-надкостничного лоскута начинают с дугообразного рассечения надкостницы скальпелем, отступив на 1 см кнутри от краев кожного разреза. Надкостницу отслаивают от разреза в обе стороны на ширину, равную диаметру фрезы, которой затем наносят в зависимости от величины создаваемого трепанационного дефекта 5-7 отверстий с помощью ручного или электрического трепана. Сначала используется копьевидная фреза, а при появлении костных опилок, окрашенных кровью, что свидетельствует о попадании фрезы в диплоический слой кости, копьевидную фрезу заменяют конусовидной или шаровидной фрезой, чтобы не «провалиться» в полость черепа.
Участки между этими отверстиями пропиливают проволочной пилой Джильи. Из одного отверстия в другое пилу проводят с помощью тонкой стальной пластинки — проводника Поленова. Распил ведут под углом 45° к плоскости операционного поля. Благодаря этому наружная поверхность лоскута кости оказывается больше внутренней: при возвращении лоскута на место он не проваливается в дефект, созданный при трепанации. Так распиливают все перемычки между отверстиями, кроме одной, лежащей сбоку или снизу по отношению к основанию лоскута мягких тканей. Эту перемычку надламывают, в результате чего весь костный лоскут остаётся связанным с неповреждёнными участками костей только надкостницей. Костный лоскут на надкостничной ножке, через которую обеспечивается его кровоснабжение, отворачивают. Далее выполняется запланированный оперативный приём. Завершая операцию, сначала зашивают твёрдую мозговую оболочку. Костный лоскут укладывают на место и фиксируют кетгутовыми швами, проведенными через надкостницу, мышцу и сухожильный шлем. Рану мягких тканей послойно зашивают.
Хирургическое лечение церебральных аневризм в остром периоде кровоизлияния

Фото справа налево: В. Доленс, А. Королев (зав. нхо КОКБ), Ю. Хернисниеми, А. Воробьев
Нетравматические внутричерепные кровоизлияния при разрывах аневризм относятся к одним из наиболее тяжелых форм нарушений мозгового кровообращения.
В России ежегодно регистрируется около 18000 субарахноидальных кровоизлияний (САК), т.е. 13 на 100000 населения в год.
Что такое аневризма и у кого она чаще встречается.
Наиболее часто САК развивается у лиц среднего и пожилого возраста. У больных в возрасте от 40 до 59 лет его частота достигает 50%.
Аневризма представляет собой выпячивание стенки артерии, обычно в области бифуркации сосуда или в месте отхождения от нее крупных ветвей. Характерным для аневризмы является отсутствие трехслойной сосудистой стенки — отсутствие мышечного слоя и эластической мембраны. Стенка аневризмы состоит из соединительной ткани, прорастающей наружную и внутреннюю оболочки. Купол представлен одним тонким внутренним слоем, поэтому кровотечение возникает именно отсюда.
По конфигурации они бывают мешотчатыми, вёретенообразными и фузиформными а также однокамерными и многокамерными. По величине аневризмы делят на милираные (до 3 мм), обычные (от 4 до 15 мм), большие (от 15 до 25 мм), гигантские (более 25 мм). Аневризмы обычно бывают одиночными, но могут быть и множественными (в 15% случаев), располагаясь на различных артериях. В подавляющем числе наблюдений (90-91%) аневризмы располагаются в переднем отделе
артериального круга большого мозга (виллизиева круга) и толь¬ко 9-10% аневризм локализуются в ВББ.
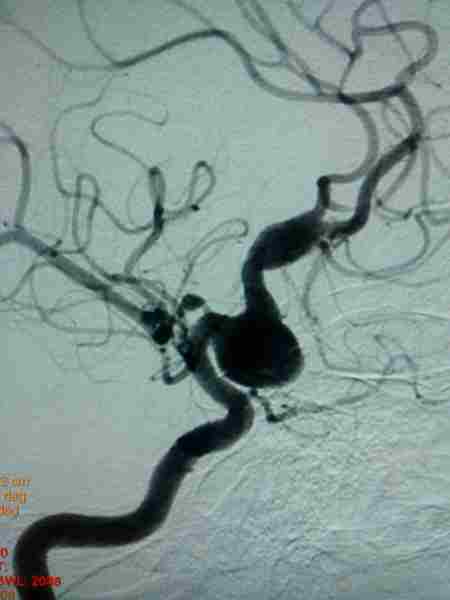
Пример множественных аневризм. Мешотчатая и фузиформная (веретенообразная) аневризмы правой передней мозговой артерии (ПМА).
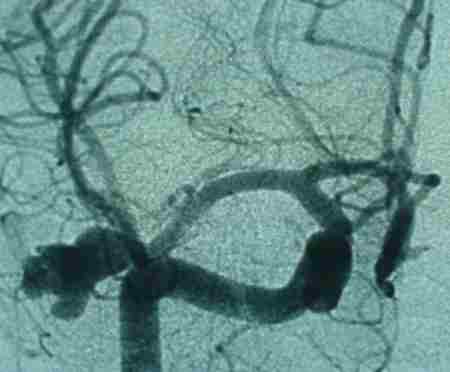
Пример многокамерной аневризмы развилки правой СМА.
При САК кровь поступает под паутинную оболочку и распространяется по базальным цистернам большого мозга. Кровь попадает также в цистерны задней черепной ямки (препонтинную, большую затылочную, мостомозжечкового угла) и далее поступает в позвоночный канал. Источник и интенсивность кровоизлияния определяют характер распространения крови по субарахноидальным пространствам — оно может быть локальным, а может заполнять все субарахноидальные пространства головного мозга с образованием сгустков крови в цистернах. При разрушении мозговой ткани в области кровоизлияния появляются участки паренхиматозного кровоизлияния в виде пропитывания мозгового вещества кровью или формирования гематомы в веществе мозга (субарахноидально-паренхиматозное кровоизлияние).

Разрыв аневризмы ПСА с массивным базальным и паренхиматозным (и немного вентрикулярным) кровоизлиянием.
При значительном поступлении крови в субарахноидальное пространство может возникнуть рефлюкс крови в желудоч¬ковую систему через вывороты IV желудочка (отверстия Мажанди и Люшка) и далее — через водопровод мозга в III и бо¬ковые желудочки. Возможно и прямое проникновение крови в желудочки мозга через поврежденную конечную пластину, что чаще бывает при разрывах аневризмы передней соединительной артерии (субарахноидально-вентрикулярное кровоизлияние). При значительном паренхиматозном кровоизлиянии на фоне САК возможен прорыв гематомы в желудочки мозга (субарахно- идально-паренхиматозно-вентрикулярное кровоизлияние).
Клиника разрыва аневризм мозга.
Клиническая картина САК при разрыве аневризмы развивается остро, иногда на фоне или после физического и эмоционального напряжения. Возникает сильная головная боль. Чаще пациенты описывают ее как головную боль «жгучего», «распирающего» характера, «как будто в голове разлился кипяток». На фоне головной боли развивается кратковременное или длительное угнетение сознания от умеренного оглушения до комы. В остром периоде кровоизлияния нередко возникают психомоторное возбуждение, гипертермия, тахикардия, повышение артериального давления. Неврологическая картина характеризуется развитием менингеального синдрома (ригидность мышц затылка, положительный симптом Кернига, светобоязнь, повышенная чувствительность к шуму и др.). Подобная типичная клиническая картина САК отмечается у 72% пациентов. Однако почти у каждого третьего больного с САК наблюдается иная клиника. Выделяют следующие атипичные варианты САК, для которых характерным является один из ведущих синдромов:
— мигренеподобный;
— ложновоспалительный;
— ложногипертонический;
— ложнорадикулярный;
— ложнопсихотический;
— ложнотоксический.
Неврологическая симптоматика которая развивается при разрывах аневризм той или иной локализации, бывает обусловлена не только эффектом самого САК или паренхиматозного кровоизлияния, но и ишемическими изменениями в мозговой ткани вследствие сосудистого спазма, и тогда клиническая картина заболевания определяется бассейном спазмированных артерий, степенью сужения артерий и особенностями коллатерального кровообращения. Кроме того, при оценке клинических проявлений необходимо учитывать и сроки заболевания, каждый этап которого характеризуется определенной частотой возникновения и формой течения осложнений (повторные кровотечения из аневризмы, внутримозговая гематома, кровоизлияние в желудочки, гидроцефалия, спазм артерий и ишемия мозга, электролитные и эндокринные нарушения, кардиоваскулярные и легочные осложнения и др.).
При всем многробразии клинической картины в практической неврологии и нейрохирургии используют классификации тяжести состояния. К настоящему времени известно более 50 классификаций, которые применяют для оценки тяжести состояния при САК. Наиболее распространенной из них является классификация, предложенная
W. Hunt и R. Hess
I. Бессимптомное течение или слабая головная боль и легкая ригидность мышц затылка.
II. Умеренная или сильная головная боль, ригидность мышц затылка, парез черепно-мозговых нервов.
III. Оглушение, сонливость, спутанность. Умеренный неврологический дефицит.
IV. Сопор, умеренный или выраженный гемипарез, ранняя децеребрационная ригидность.
V. Глубокая кома, децеребрационная ригидность, внешний вид умирающего.
Диагностика субарахноидальных кровоизлияний.
Верификацию кровоизлияния традиционно выполняют путем поясничной пункции.
Компьютерная томография (КТ) головного мозга.
Является ведущим методом в диагностике САК, особенно в первые часы и сутки кровоизлияния. С помощью КТ определяют не только интенсивность базального кровоизлияния и его распространенность по цистернам, но и наличие и объем паренхиматозного и вентрикулярного кровоизлияний, выраженность гидроцефалии, наличие и распространенность очагов ишемии мозга, выраженность и характер дислокационного синдрома.
Кроме того, с помощью КТ иногда удается диагностировать и истинную причину кровоизлияния. Выявляемость САК в первые 12 часов после кровоизлияния достигает 95,2%, в течение 48 часов 80-87%; на 3-и-5-е сутки — 75% и на 6-21-е сутки — всего 29%. Степень выявляемости сгустков крови при САК зависит не только от интенсивности самого кровоизлияния, но и от соотношения сгустков крови и плоскости срезов на КТ. Оптимальным для диагностики САК считается условие, когда плоскость сгустков перпендикулярна плоскости срезов на КТ и толщина сгустков превышает ширину среза КТ. Поэтому САК чаще обнаруживают при сгустках крови толщиной более 1,5 мм.
Наиболее распространенной КТ-классификацией кровоизлияния является классификация, предложенная С.М Fisher et al. в 1980 г.
Данные КТ четко — коррелируют с тяжестью состояния и прогнозом заболевания.
Чем выраженнее кровоизлияние по КТ, тем более вероятно развитие церебрального ангиоспазма и соответственно фатальных ишемических осложнений.
Диагностика источника кровотечения.
Непосредственная визуализация аневризмы возможна тремя методами диагностики: дигитальной субтракционной ангиографией (ДСА), магнитно-резонансной ангиографией (МРА), компьютернотомографической ангиографией (КТА).
Диагностику церебральных аневризм (ЦА) следует начинать с неинвазивных методов.
Компьютерно-томографическая ангиография.
Современная трехмерная КТА с ЗD-реконструкцией (KT-3D-A) обладает чувствительностью в пределах от 87,9 до 97% и специфичностью от 95 до 100%.
При КТА можно получать трехмерное изображение и определять пространственную конфигурацию аневризмы, взаиморасположение с близлежащими структурами.
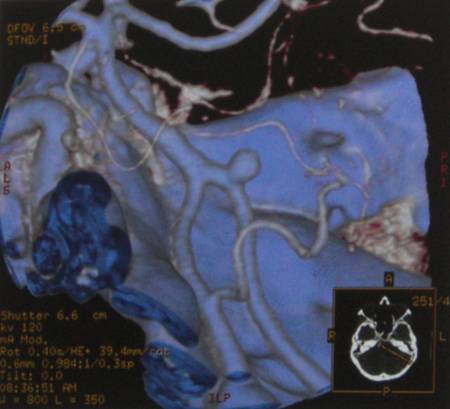
КТА. Аневризма правой позвоночной артерии.
Магнитно-резонансная ангиография.
МРА обеспечивает верификацию внутричерепных аневризм с чувствительностью в пределах от 74 до 100% и специфичностью от 74 до 100%. Чувствительность МРА в обнаружении аневризм диаметром более 3 мм составляет 86%, что сравнимо с результатами ДСА. Отмечено снижение чувствительности МРА при диаметре аневризмы менее 3-5 мм.
Имеется ряд параметров, которые влияют на способность МРА обнаруживать аневризмы: размер ЦА, скорость и направление кровотока в аневризме относительно магнитного поля, тромбоз и кальциноз, — поэтому МРА предпочтительно выполнять в первые 3 суток после кровоизлияния. В сроки от 3 суток до 3 недель после кровоизлияния ее точность снижается из-за биотрансформации молекулы гемоглобина.
Как неинвазивный метод МРА широко применяют в качестве скринингового исследования у пациентов с высоким риском наличия ЦА.
Дигитальпая субтракционная ангиография.
Селективную ДСА необходимо выполнять в следующих случаях: нет возможности проведения КТА или МРА; если эти исследования не выявили источник кровоизлияния или полученные данные недостаточны для проведения хирургического вмешательства. Исследование должно быть выполнено в следующем объеме: оба каротидных бассейна и обе позвоночные артерии. ДСА осуществляют в прямой, боковой, косой, а при необходимости в других атипичных проекциях.
Помимо выявления источника кровоизлияния, необходимо оценить степень выраженности и распространенность сосудистого спазма, особенности кровообращения.
При отсутствии визуализации аневризмы при ДСА у пациентов с типичной клиникой аневризматического САК, при ангиографических признаках сосудистого спазма целесообразно через 3-4 недели после кровоизлияния выполнить повторное ангиографическое исследование, которое позволяет выявить ранее не контрастированные аневризмы приблизительно еще у 3% больных.
Диагностика ангиоспазма.
Сосудистый спазм развивается исключительно при разрывах аневризм и практически не наблюдается при разрывах артериовенозных мальформаций и САК иной этиологии.
Под сосудистым спазмом следует понимать изменения всех слоев артериальной стенки, приводящие к сужению просвета артерии. Они возникают в ответ на кровоизлияние в церебральные цистерны.
Морфологические, изменения в сосудистой стенке следующие: отек и десквамация эндотелия, сокращение гладкомышечных клеток с их последующим некрозом и заместительным склерозом, разрушение эластических волокон наружной и внутренней эластических мембран, коллагеновых волокон адвентиции. Подобные морфологические изменения приводят к сужению просвета артерий, изменению упругоэластических свойств артерии, пристеночному тромбообразованию и иногда полному тромбозу артерий мозга (в 20% случаев). Из вышеописанных морфологических изменений следует, что, во-первых, термин «сосудистый спазм» весьма условен, более уместен термин «констриктивная ангиопатия», во-вторых, более понятным становится, почему терапия артериального спазма спазмолитическими препаратами является неэффективной.
Обычно ангиоспазм при САК развивается с 3-4-х суток от начала заболевания, его пик отмечается на 7-14-е сутки и в последующие дни наблюдается регресс.
Важную роль в оценке выраженности ангиоспазма и характера развивающейся у пациента ишемии мозга играют траскраниальная допплерография — ТКДГ, ЭЭГ и регистрация акустических стволовых вызванных потенциалов. ТКДГ является наиболее чувствительным методом диагностики спазма. При увеличении линейной скорости кровотока до 120 см/с сужение просвета определяется на ангиограммах, а при повышении линейной скорости кровотока более 200 см/с у больных обнаруживаются неврологические расстройства, обусловленные ишемией мозга.
Хирургическое лечение больных с разрывом аневризмы.
Основной целью операции у больных с аневризмами являются выключение аневризмы из кровотока для предотвращения повторных кровотечений и устранение сгустков крови из базальных цистерн для предотвращения сосудистого спазма и ишемии мозга. Учитывая, что и ишемические осложнения, и повторное кровоизлияние возникают через несколько дней после разрыва аневризмы, необходимо стремиться произвести операцию в течение первых 3 суток заболевания. В случаях поздней госпитализации больных с САК и запоздалой диагностики аневризмы, когда развиваются сосудистый спазм и ишемия мозга, операцию приходится откладывать на несколько недель до регресса ишемических осложнений.
В первые 2 недели после разрыва аневризмы повторные кровотечения происходят у 15-20% больных. В первые 6 месяцев после разрыва аневризмы они развиваются у 50% пациентов с летальностью до 60%. В последующем риск повторного кровотечения составляет 3% в год со смертностью 2% в год, что склоняет многих нейрохирургов к тактике ранних оперативных вмешательств.
Показания к проведению открытых хирургических вмешательств.
1) больные с I-II степенью тяжести САК по Hunt-Hess;
2) больные с III степенью тяжести САК по Hunt-Hess при легком или умеренном ангиоспазме (скорость кровотока в сегменте M1 менее 200 см/с);
3) больные с III-IV степенью тяжести САК по Hunt-Hess, ес¬ли тяжесть состояния обусловлена внутримозговой гематомой с развитием дислокационного синдрома.
Показаниями к отсроченному хирургическому лечению являются:
1) III-IV степень тяжести САК по Hunt-Hess при наличии умеренного или выраженного ангиоспазма (скорость кровотока в сегменте M1 менее 200 см/с), III-IV тип изменений ЭЭГ;
2) анатомически сложные аневризмы (гигантские аневриз¬мы, аневризмы базилярной артерии);
3) V степень тяжести САК по Hunt-Hess без внутримозговой гематомы.
Эндоваскулярные методы лечения аневризм.
Абсолютные показания:
1) невозможность клипирования аневризмы в ходе открытой операции.
Приоритетные показания:
1) труднодоступность аневризмы для прямого хирургического вмешательства (аневризмы кавернозного и параклиноидного отделов ВСА, вертебрально-базилярного бассейна);
2) больные старшей возрастной группы (старше 75 лет);
3) тяжелое состояние больных (III-IV степень по Hunt-Hess);
4) фузиформные и расслаивающие аневризмы.
Операции по поводу разрыва аневризм производят под общим обезболиванием, обязательно с использованием операционного микроскопа и микрохирургической техники.
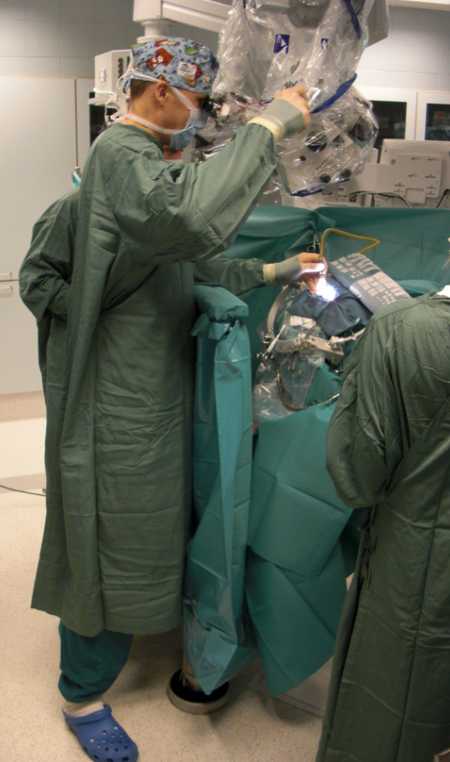
Хирург работает с микроскопом (Хельсинки, Финляндия, проф. Ниемели М.).
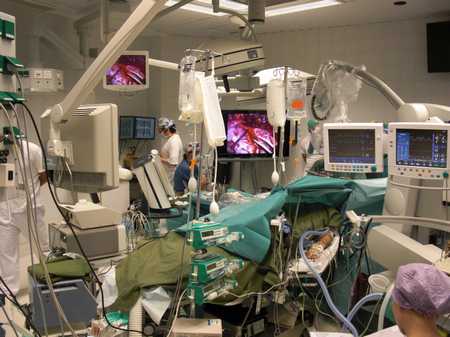
Общий вид нейрохирургической операционной (Хельсинки, Финляндия).
Операция складывается из нескольких этапов: трепанации черепа в лобно- височной области, вскрытия твердой мозговой оболочки, paссeчения арахноидальной оболочки на основании мозга и аспирации СМЖ, выделения магистральных сосудов головного мозга, выделения несущей аневризму артерии, самой аневризмы и выключения ее из кровотока путем клипирования.
Факторами риска в хирургии аневризм в остром периоде кровоизлияния являются:
— тяжелое состояние больного (IV-V степень по Hunt-Hess);
— наличие распространенного спазма и ишемии мозга;
— внутримозговая гематома объемом более 30 мл;
— прорыв крови в желудочки мозга и окклюзионная гидроцефалия;
— смещение срединных структур мозга более 5 мм.
Лечение в послеоперационном периоде.
До настоящего времени каких-либо эффективных методов медикаментозной терапии сосудистого спазма не существует. Поэтому при разрыве аневризмы для профилактики ишемии мозга или ее лечения проводят терапию, направленную на нормализацию перфузии мозга. С этой целью широко используют так называемую ЗН-терапию (hypertensia, hypervolemia, hemodilucia). До настоящего времени не установлено, какой из этих компонентов наиболее важен. Артериальное давление удерживают на уровне 15-20% выше обычного для данного больного давления, используя симпатомиметики. Гиперволемия достигается внутривенным введением альбумина и плазмы, гемодилюция — физиологического раствора. Гематокритное число не должно превышать 38-40. Подобная терапия позволяет значительно снизить риск развития ишемии мозга (до 15%) или уменьшить ее выраженность. Однако подобная терапия не позволяет предотвратить развития повторных кровотечений из аневризмы. Кроме того, при ЗН-терапии увеличивается риск развития сердечно-легочной недостаточности, почечной недостаточности, нарушений водно-электролитного баланса, коагулопатий.
Для профилактики ишемии и в ее лечении необходимо использовать антагонист кальция — нимодипин. Являясь блокатором кальциевых каналов, нимодипин препятствует поступлению ионов кальция через поврежденную мембрану в клетку и предотвращает ее повреждение. Первоначально препарат вводят внутривенно, через инфузомат, доводя скорость инфузии до 5 мл/час, под контролем артериального давления, затем назначают перорально. Иcпoльзовaниe препарата позволяет уменьшить число неврологических расстройств, обусловленных спазмом, на 12%. Необходимо помнить, что при внутривенном введении нимодипина может развиться артериальная гипотония, поэтому параллельно необходимо вводить и симпатомиметики. поддерживая нормальную перфузию мозга.
При написании статьи использованы материалы методических рекомендаций (№ 37) ДЗ Москва 2008.
Учреждение-разработчик: Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского.
Составители: Академик РАМН проф. В.В. Крылов, канд. мед. наук А.Э. Талыпов.
Автор статьи: врач-нейрохирург Воробьев Антон Викторович Рамка вокруг текста
Краниотомия – операция трепанации черепа
Суть краниотомии заключается в выполнении разреза («томия» – греч.) черепной коробки («кранио» – греч.). Это общее понятие, описывающее целый ряд операций, в ходе которых производится хирургическое вскрытие черепной кости. Эта операция наиболее распространена в нейрохирургии – медицинском направлении, отвечающем за хирургию мозга и центральной нервной системы.
Краниотомия выполняется с целью коррекции таких медицинских состояний, как доброкачественные и злокачественные опухоли головного мозга (в этих случаях иногда необходимо выполнить биопсию или даже частичное или полное удаление опухоли; операция удаления части опухоли мозга называется также «частичным удалением» или «операцией по снижению объема опухолевой ткани» – debulking), устранение патологических изменений сосудов головного мозга (например, аневризма сосудов головного мозга и артериовенозная мальформация (arteriovenous malformation – AVM)), лечение местных травм (таких как перелом или внутримозговое кровотечение), лечение инфекционных процессов мозга (гнойник, абсцесс), а также с целью лечения ряда неврологических явлений (таких как острый эпилептический приступ).
Метод краниотомии, как правило, применяется в случае первичных опухолей мозга – в большинстве случаев доброкачественных (типа менингеомы) или злокачественных (типа глиомы (glioma)), глиом низкой степени злокачественности (степени 1 и 2), редких видов опухолей мозга (например, гермином или лимфом), а также вторичных опухолей мозга.
Каковы ожидаемые результаты данной процедуры?
Краниотомия – это операция, которая выполняется при различных медицинских состояниях:
При помощи операции будет достигнуто улучшение функциональных и сенсорных возможностей пациента, поскольку операционное лечение в большинстве случаев облегчает характерные симптомы заболевания. Вместе с тем важно помнить, что речь идет об операции трепанации черепа и проникновении в мозг, что считается одной из самых сложных операций в нейрохирургии.
Как на практике выполняется эта процедура?
Краниотомию можно выполнять под местным или общим наркозом. Непосредственно перед операцией пациент будет подключен к системе, предназначенной для внутривенного введения препаратов, через которую анестезиолог введет успокоительные препараты, цель которых – помочь пациенту снизить ощущение тревоги.
Если принимается решение о выполнении регионарной анестезии, это значит, что хирург и анестезиолог смогут разговаривать с пациентом на протяжении всей операции. Если принимается решение о выполнении общего наркоза, это значит, что пациент погрузится в глубокий сон на все время операции и не будет осознавать того, что с ним происходит. В обоих случаях голова пациента будет закреплена с помощью особого устройства, которое называется «держатель головы», и его назначение состоит в том, чтобы предотвратить любое движение или смещение головы, и за счет этого обеспечить наибольшую точность в ходе выполнения операции.
Сегодня в ходе операции краниотомии хирурги пользуются высокотехнологичной системой навигации, позволяющей обнажить в точности тот участок мозга, который предполагается оперировать, и уменьшить степень повреждения окружающих областей и тканей. Системы навигации оснащены современными средствами визуализации, такими как ультразвук, МРТ (визуализация с помощью магнитного резонанса) и КТ (компьютерная томография).
Перед началом операции предварительно побритый участок операционного поля будет обработан антисептическим раствором. После того, как будет установлено, что наркоз начал действовать, хирург выполнит разрез кожи головы, с тем чтобы оголить черепную кость. На следующем этапе часть черепной кости будет распилена специальной высокоскоростной дрелью и удалена. Удаление части черепной кости обнажит оболочку мозга, которая называется «твердой мозговой оболочкой» (dura mater). Хирург вскроет твердую мозговую оболочку и обнажит тот участок, который предстоит прооперировать.
Начиная с этого этапа, операция будет проходить под специальным микроскопом. В случае наличия опухоли ее удаление будет проводиться с помощью аспиратора (suction), электрического пинцета (Bipolar Forceps) или ультразвукового аспиратора (Ultrasonic Aspirator), который разделяет ткани при помощи ультразвука. Кровотечение в мозгу будет дренировано, и в случае необходимости обработки кровеносных сосудов хирург прижжет проблемные сосуды и закроет операционную область.
В конце операции хирург тщательно проверит, что отсутствует кровотечение из всех кровеносных сосудов операционного поля, и только после этого он наложит шов на твердую мозговую оболочку и вернет на место участок черепной кости. После того, как участок черепной кости будет закреплен, хирург совместит края разреза на коже, наложит на них швы и накроет прооперированный участок повязкой.
В случае необходимости хирург вставит дренаж для оттока жидкости и крови из операционной области, который будет находиться там как минимум два дня. Также, возможно, будет необходимость в поддержке дыхания пациента после операции с помощью аппарата искусственной вентиляции легких.
Какой наркоз будет использоваться в ходе процедуры?
Регионарный или общий.
Сколько времени будет длиться процедура?
3–4 часа или больше, в зависимости от вида операции.
Часть пациентов будет получать стероиды до или после операции с целью уменьшения отека в операционной области. Также пациент должен будет получать противосудорожные препараты с целью предотвращения эпилептических приступов.
Как подготовиться к операции и госпитализации?
Следует взять с собой медицинское заключение семейного или лечащего врача, содержащее диагнозы и принимаемые пациентом лекарственные препараты, для того чтобы хирург и анестезиолог получили наиболее полную медицинскую и личную информацию о пациенте.
Необходимо пройти анализы крови, включающие в себя общий анализ крови и биохимический анализ крови, а в особых случаях потребуется также анализ свертываемости крови. Пациентам старше 40 лет необходимо выполнить и представить результаты ЭКГ.
Также необходимо провести визуализацию состояния мозга. Как правило, это компьютерная томография мозга (КТ), магнитно-резонансная томография мозга (МРТ), функциональная магнитно-резонансная томография (фМРТ) или ангиография (катетеризация сосудов мозга). В некоторых случаях, возможно, потребуются дополнительные обследования, такие как ПЭТ-сканирование (позитронное сканирование) и КТ-ангио (визуализация кровеносных сосудов).
За неделю до операции Вы должны прекратить прием противосвертывающих препаратов (таких как аспирин и кумадин). Необходимо проконсультироваться с семейным врачом или хирургом относительно необходимости применения альтернативных препаратов.
В день проведения операции, за 6 часов до ее начала, необходимо воздерживаться от еды и питья (включая воду). Рекомендуется воздерживаться даже от жевания жевательной резинки и курения. Перед входом в операционную необходимо снять зубные протезы, украшения и личную одежду.
Что будет происходить после операции?
Краниотомия – это серьезная операция, требующая госпитализации длительностью от 3 до 6 дней.
После того, как пациент окажется в послеоперационном отделении и выйдет из состояния наркоза, он будет переведен в реанимационное отделение как минимум на 24 часа для продолжения наблюдения и тщательного мониторинга. В зависимости от своего состояния, пациент может оставаться в реанимационном отделении около двух дней.
По окончании пребывания в реанимации его переведут в обычное отделение, где он уже сможет с помощью персонала садиться на кровати или в кресле, есть мягкую пищу и пить. Продолжительность госпитализации и дата выписки будут установлены в зависимости от эффективности восстановления после операции.
Что произойдет после выписки из больницы?
В большинстве случаев примерно через неделю после госпитализации пациент будет выписан домой.
Во время периода выздоровления важно тщательно следить за чистотой послеоперационной области и ежедневно промывать ее водой и мылом.
Следует избегать физической нагрузки в течение 6–8 недель после операции. Рекомендуется воздерживаться от вождения автомобиля, пока окончательно не исчезнут слабость и головокружение.
Если Вы или Ваши близкие нуждаетесь в проведении квалифицированной программы диагностики и лечения Вам рекомендуется обратиться к представителю нашего международного отдела, который поможет Вам в организации приезда в Израиль и в проведении профессиональной медицинской программы.
