ацетил л карнитин как принимать для мозга
Ацетил-L-карнитин, 500 мг, 50 вегетарианских капсул, NOW
Артикул: 0075 Штрихкод: 733739000750
Артикул: 0075 Штрихкод: 733739000750
Чем полезен препарат Dymatize Acetyl-L-Carnitine?
С возрастом Ацетил-L-Карнитин вырабатывается в организме всё в меньшем количестве, запуская, таким образом, процессы старения, особенно головного мозга. Дефицит этого вещества приводит к серьёзным нарушениям в работе органов и их систем.
Дополнительный приём ацетил-L-карнитин позволит:
«Ацетил-L-Карнитин» – эффективное средство для профилактики сенильного (старческого) слабоумия, идиопатического синдрома паркинсонизма, хронической усталости, туберкулёза лёгких, инсульта, инфаркта. Кроме того, препарат выступает прекрасной диетической добавкой к основному рациону, поскольку характеризуется свойством подавления аппетита и уменьшения слабости.
Важные особенности
Натуральный продукт, в составе которого отсутствуют добавки сои, глютена, дрожжей, консервантов, ГМО. Препарат соответствует требованиям международной системы оценки качества GMP.
Биологически активная добавка (БАД). Не является лекарственным средством.
NOW Acetyl-L-Carnitine– Ацетил-L-Карнитинрекомендуется принимать в качестве биологически активной добавки к пище по 1 капсуле 1 – 3 раза в день за 30 мин. до еды Не рекомендуется принимать при эпилепсии и перед сном! Для достижения большего эффекта можно применять с NOW Pantothenic Acid – Пантотеновая Кислота.
ацетил-L-карнитин 500 мг, желатин (капсула), целлюлоза, стеариновая кислота (растительный источник), стеарат магния (растительный источник)
не содержит: сахар, соль, крахмал, дрожжи, пшеницу, клейковину, кукурузу, сою, молоко, яйца, моллюски и консерванты
NOW Acetyl-L-Carnitine Ацетил-L-Карнитин 500мг капс 740мг N 50
Внешний вид товара может отличаться от изображённого на фотографии
Добавить в корзину
Описание
Продукт не содержит ГМО и подходит для веганов и вегетарианцев. Используется для профилактики ряда неврологических заболеваний и достижения общеукрепляющего эффекта.
улучшение связей между нейронами в головном мозге;
стимулирование иммунной системы;
транспорт и утилизация жира;
увеличение кровообращения в мышечной ткани;
регуляция углеводного и белкового обмена;
влияние на мужскую половую систему, регуляция концентрации тестостерона в крови;
повышение резистентности организма к интенсивным физическим нагрузкам;
регуляция цикла сна и бодрствования;
стимуляция работы нервной системы;
влияние на сон, его продолжительность и структуру.
Показания к применению:
Ацетил-L-Карнитин применяется в следующих ситуациях:
нейродегенеративные заболевания (болезнь Альцгеймера, деменция);
синдром хронической усталости;
постоянный стресс в жизни;
профилактика инсульта, инфаркта;
паркинсонизм и болезнь Паркинсона;
избыточная масса тела, ожирение;
физическое и умственное переутомление;
сниженная концентрация, внимание и работоспособность;
процесс преждевременного старения.
Дозировка и способ применения:
В одной упаковке БАД содержится 50 вегетарианских капсул. Ацетилкарнитин рекомендуется употреблять по 1 капсуле не более 2 раз в сутки.
Приобрести БАД, как и другую продукцию NowFoods, можно в интернет-магазине www.nowfoods-shop.com. Любые вопросы, касаемые цены или наличия товара на складе, можно задать менеджерам компании. После оформления заказа необходимо будет выбрать способ доставки. Она осуществляется как в пределах Московской области, так и в любые другие города и регионы России
Перед применением требуется консультация специалиста.
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач.
Режим хранения, взаимодействие и побочные действия указаны в инструкции.
Когнитивные нарушения: возможности применения ацетил-L-карнитина
Опубликовано в журнале:
Неврология/ревматология № 2, 2012
П.Р.Камчатнов
ГБОУ ВПО РНИМУ им. Н.И.Пирогова Минздрава РФ, Москва
Нормальное функционирование центральной нервной системы (ЦНС) зависит от адекватного потребностям поступления как энергетических субстратов и кислорода, так и целого ряда веществ, необходимых для нормального протекания анаболических и катаболических процессов, а также принимающих участие в целом ряде химических реакций.
Одним из них является карнитин, одна из основных функций которого – обеспечение транспорта свободных жирных кислот через митохондриальную внутреннюю мембрану. В результате этого процесса в митохондрии поступают длинноцепочечные жирные кислоты, которые впоследствии метаболизируются в системе β-окисления до ацетил-коэнзима и участвуют в процессах энергопродукции. Эффективность образования энергии за счет утилизации жирных кислот близка к таковой в цикле трикарбоновых кислот (цикл Кребса).
В организме максимальной активностью обладают левовращающие формы карнитина и его метаболитов. Считается, что наиболее активным из них является ацетил-L-карнитин – АЛК (Карницетин). В мозге Карницетин обладает мощным регуляторным воздействием на энергетический метаболизм. На протяжении длительного времени считалось, что основные эффекты карнитина и Карницетина реализуются исключительно за счет поступления в митохондрии альтернативного глюкозе энергетического субстрата – жирных кислот. Именно способность карнитина и ряда его производных обеспечивать митохондрии нейронов энергетическими субстратами послужила основанием для его широкого применения у больных с острым ишемическим инсультом, некоторыми нейродегенеративными заболеваниями, а также рядом соматических заболеваний [2, 3, 30].
За последние годы в результате многочисленных экспериментальных исследований были получены новые сведения о биохимических и физиологических эффектах карнитина и его производных, в частности, Карницетина, которые значительно расширили понимание механизмов их действия и явились основанием для более широкого применения препарата в клинической практике.
Так, было установлено, что Карницетин обладает способностью уменьшать выраженность повреждающих эффектов оксидантного стресса. Оказалось, что введение эфиров карнитина непосредственно перед развитием острой церебральной ишемии у крыс или после формирования локальной ишемии мозга не только обеспечивало значительную сохранность запасов аденозинтрифосфата АТФ, но и уменьшало образование свободных радикалов [5]. Результатом применения препарата у экспериментальных животных оказалась неизмененность значительного числа нейронов в зоне ишемии.
Сходные в целом результаты были получены и в условиях модели гипобарической гипоксии [7]. Пероральное назначение Карницетина в период, предшествующий развитию гипоксии, приводило к значительному снижению образования избыточного количества свободных радикалов (предупреждало развитие оксидантного стресса). Важным следствием применения препарата явилось уменьшение выраженности воздействия оксидантного стресса и на другие звенья патобиохимического каскада. Важно, что в итоге улучшался функциональный исход модели ишемии, о чем свидетельствовали результаты выполнения соответствующих тестов.
Уменьшение выработки свободных радикалов вследствие применения Карницетина сопровождается целым рядом клинически ценных эффектов. В частности, снижается выброс активирующего нейротрансмиттера глутамата в синаптическую щель, что обеспечивает ограничение повреждающего действия эксайтотоксичности [13]. В условиях данного эксперимента был продемонстрирован дозозависимый эффект Карницетина, который заключался в уменьшении объема зоны инфаркта вследствие окклюзии средней мозговой артерии.
Следует также отметить, что введение Карницетина, в первую очередь, оказывает защитный от повреждающего действия свободных радикалов эффект на митохондрии нейронов [25]. Вследствие применения препарата уменьшается количество гигантских и незрелых митохондрий, обладающих низкой устойчивостью к действию повреждающих факторов, а также наблюдается большая сохранность митохондриальной ДНК, повреждение которой лежит в основе ряда дегенеративных заболеваний, в частности, болезни Альцгеймера (БА). Результаты приведенных экспериментальных данных дают основание говорить о наличии у Карницетина собственного антиоксидантного эффекта, реализация которого тесно связана с изменением клинической картины заболевания.
Несомненный интерес представляет способность Карницетина уменьшать повреждающее действие дефицита кислорода за счет влияния на некоторые ферментные системы, а также путем активации ряда регуляторных белков [8]. На фоне введения препарата было зарегистрировано уменьшение активности каспазы-3, цитохрома С, экспрессии белка Bcl-2, которое носило дозозависимый характер.
В этой связи важно, что препарат оказывает свое нейропротективное действие не только в условиях острого, но и хронического повреждения головного мозга, что в значительной степени обусловлено угнетением апоптоза. Повышение выживаемости нейронов головного мозга при применении Карницетина связано также с активаций таких защитных механизмов, как фосфо инозитол-3-киназа, PKG, ERK1/2 [4].
Также имеются данные о том, что в экспериментальных условиях Карницетин способен регулировать экспрессию некоторых нейроспецифических белков (в частности, основного белка миелина, лизосомальных АТФаз), тем самым повышая устойчивость ткани к внешним воздействиям [33].
Активное влияние Карницетина на целый ряд биохимических процессов, приводящих к повреждению и даже гибели нейронов мозга, дает основание рассматривать его в качестве эффективного полимодального нейропротектора. Так, Карницетин обладает способностью восстанавливать количество рецепторов фактора роста нервов до уровня, который наблюдается у молодых животных [6].
Одним из маркеров нейродегенеративного процесса, а также естественного старения головного мозга является снижение потребления нейронами глюкозы. В условиях эксперимента было показано, что у пожилых (24месячных) крыс, ежедневно на протяжении 3мес получавших в пищу Карницетин, регионарное потребление глюкозы головным мозгом оказалось достоверно выше, чем у их сверстников, не получавших Карницетин [11]. Наиболее значительный прирост наблюдался в структурах лимбической системы, а также в таламусе.
Подобного рода активизация энергетического метаболизма мозгового вещества рассматривается авторами исследования как механизм, препятствующий его естественному старению. Данный факт имеет особый интерес с учетом снижения с возрастом в тканях организма самого карнитина и его соединений [24].
Кроме того, уменьшение повреждения мозгового вещества, обусловленное естественным процессом старения, может быть связано со способностью Карницетина уменьшать разрушение митохондрий нейронов и окисление ДНК и РНК [16]. Помимо большей структурной сохранности органелл и нуклеиновых кислот введение Карницетина в организм экспериментальных животных сопровождалось улучшением состояния памяти, оцениваемой по набору стандартных тестов. Сопоставимые результаты, свидетельствующие о способности Карницетина предотвращать или уменьшать выраженность нейродегенеративного процесса у пожилых экспериментальных животных (крысы) на фоне церебральной ишемии, были получены и в результате более поздних исследований [12].
Наконец, были получены обнадеживающие данные о способности Карницетина оказывать воздействие на некоторые механизмы нарушений белкового обмена в головном мозге, лежащие в основе развития БА.
Оказалось, что введение экспериментальным животным Карницетина стимулирует активность α-секретазы, обеспечивающей трансформацию белка-предшественника амилоида в растворимую форму, доступную для элиминации из нейронов [10]. Установление данного факта позволило с новых позиций взглянуть на нейропротективные эффекты Карницетина, напрямую не связанные с энергетическим обеспечением нейронов и восполнением дефицита ацетилхолина.
Важным итогом экспериментального изучения Карницетина на разных экспериментальных моделях стареющего и подвергшегося воздействию вредоносных факторов мозга лабораторных животных явилось установление факта улучшения памяти, повышения способности к запоминанию новой информации и расширения способности к обучению [14].
Данные доказательной медицины
Результаты многочисленных экспериментальных исследований, несомненно, являются обнадеживающими в плане существующих у Карницетина нейропротективных эффектов, вместе с тем применение препарата в клинической практике требует изучения его клинических эффектов и переносимости у человека, что и послужило основанием для проведения целого ряда клинических исследований.
Важным итогом клинических исследований явилось подтверждение возможности применения Карницетина у пациентов с артериальной гипертензией – одним из ведущих факторов развития цереброваскулярных расстройств, в частности, сосудистой деменции и деменции смешанного типа.
Двойное слепое исследование было проведено в группе пациентов с ишемической болезнью сердца и артериальной гипертензией, основная группа которых получала на протяжении 8 нед комбинацию Карницетина и α-липоевой кислоты, а контрольная – плацебо [19]. К окончанию периода исследования уровень артериального давления в основной группе был достоверно ниже, чем в контрольной, при этом достоверное снижение регистрировалось у пациентов с исходно наиболее высоким его уровнем, а также у больных с метаболическим синдромом.
Большую ценность представляет наблюдение того факта, что комбинированная терапия сопровождалась дилатацией плечевой артерии и снижением ее тонуса, что отражает уменьшение выраженности явления эндотелиальной дисфункции.
Продемонстрированная в ряде клинических исследований эффективность Карницетина при целом ряде состояний, тесно ассоциированных с развитием расстройств мозгового кровообращения (стенозирующий атеросклероз, сахарный диабет, застойная сердечная недостаточность и др.) и деменции альцгеймеровского или смешанного типа, дают веские основания рассматривать его в качестве средства для комплексного лечении указанных состояний и предупреждения поражения головного мозга [15, 20].
Особый интерес представляет возможность применения Карницетина у больных с когнитивными нарушениями с целью предупреждения развития тяжелой деменции. Имеются данные о том, что применение Карницетина способно в определенной степени также отсрочить наступление тяжелой деменции у пациентов с умеренными когнитивными нарушениями [18]. В одно из первых исследований, посвященных изучению данной проблемы, были включены всего 7 пациентов с БА (группу сравнения составили 5 пациентов, сопоставимых по возрасту, характеру и выраженности когнитивного дефицита), которые на протяжении 12 мес ежедневно получали по 3,0 г Карницетина [26]. На протяжении данного периода авторы отметили стабилизацию состояния больных и замедление прогрессирования заболевания.
Сходное по своему дизайну исследование возможности применения Карницетина у пациентов с умеренно выраженными когнитивными нарушениями вследствие БА позволило ответить на вопрос о том, насколько эффективна терапия в отношении замедления развития тазовых нарушений.
Исследование продолжалось на протяжении 12 мес, больные контрольной группы получали плацебо. Оказалось, что в обеих группах к концу 12-го месяца имело место прогрессирующее когнитивное снижение. Вместе с тем более выраженный характер оно носило у пациентов, получавших плацебо. Важно также, что своевременное лечение оказалось тесно взаимосвязанным с выраженностью неврологической симптоматики.
Имеющиеся данные о положительном эффекте Карницетина у больных с когнитивными расстройствами позволяют предполагать возможность достижения положительного эффекта при его назначении пациентам с додементными формами заболевания.
Эффективность применения Карницетина в качестве средства, способного улучшать состояние когнитивных функций, изучена в ходе метаанализа серии исследований, выполненных двойным слепым способом [34]. Длительность наблюдения составила не менее 3 мес.
Оказалось, что в группе активного лечения имелось достоверно более выраженное улучшение состояния, в частности, по шкале общего впечатления, а также по комплексу психометрических тестов. Авторы отмечают очень хорошую переносимость препаратов.
Проводимая терапия, несомненно, оказывала положительный эффект, который заключался в большей сохранности когнитивных функций, замедлении процессов развития деменции по сравнению с контрольной группой (на протяжении 12 мес получали плацебо).
На сегодняшний день накоплен значительный опыт клинического применения Карницетина у пациентов с расстройствами когнитивных функций. По результатам метаанализа 21 рандомизированного контролируемого клинического исследования у пациентов, которые принимали Карницетин на протяжении от 3 до 12 мес по 1,5–2,0 г/сут, было зарегистрировано достоверное замедление прогрессирования патологического процесса или даже частичное восстановление нарушенных функций [22].
Практический интерес представляет эффективность Карницетина, установленная в ходе контролируемого рандомизированного клинического исследования в отношении купирования как когнитивного снижения в рамках БА, так и сенильной депрессии [27]. Выявление указанного факта ценно с учетом коморбидности аффективных и когнитивных нарушений у пациентов старших возрастных групп.
В целом возможность применения Карницетина в составе разных терапевтических схем широко обсуждается не только для лечения пациентов с БА, но и сосудистой деменцией, когнитивным снижением, обусловленным токсическим поражением ЦНС и его структурными изменениями, а также сопутствующими деменции патологическими состояниями: депрессивными расстройствами, синдромом хронической усталости, некоторыми соматическими заболеваниями [17].
В 2011 г. были опубликованы результаты отечественного исследования, посвященного изучению вопросов эффективности и переносимости применения Карницетина у пациентов с мягкой деменций, обусловленной БА и сосудистой деменцией [1]. Пациенты получали препарат в суточной дозе 2250–3000 мг на протяжении 12 нед.
Оказалось, что проведенное лечение оказало несомненный положительный результат в виде достоверно большей сохранности когнитивных функций по сравнению с группой больных, получавших плацебо.
Кроме того, авторы исследования подчеркивают хорошую переносимость лечения. Результаты исследования позволяют рекомендовать Карницетин для применения у пациентов с БА и сосудистой деменцией на ранних стадиях заболевания.
Помимо подтвержденной клиническими исследованиями эффективности Карницетина при БА и сосудистой деменции, имеются данные о его положительном действии при целом ряде нейродегенеративных заболеваниях, в той или иной степени сопровождающихся когнитивным снижением. Так, имеются данные, которые позволяют считать перспективным изучение возможности применения Карницетина у пациентов с атаксией Фридрейха.
Необходимо отметить, что, учитывая роль нарушений энергопродукции в патогенезе заболевания, была предпринята попытка использования в лечебных целях у данной группы больных Карницетина [31]. После проведенного 6-месячного курса применения препарата было установлено, что на фоне лечения уменьшилась выраженность атактических расстройств и снизились темпы прогрессирования заболевания.
Определенный интерес представляют данные об определенной эффективности Карницетина при таких достаточно редких генетически детерминированных заболеваниях, как липофусцинозы [21]. Продемонстрирована эффективность Карницетина и в отношении прогрессирования деменции у взрослых пациентов с болезнью Дауна [28]. При этом интересно, что замедление прогрессирования когнитивного снижения, которое наблюдалось у взрослых больных, не было зарегистрировано у молодых пациентов.
При выборе терапевтической тактики применения Карницетина необходимо иметь в виду, что кратковременные однократные курсы терапии не в состоянии оказать положительного влияния на состояние когнитивных функций и замедлить течение нейродегенеративного процесса. Как в условиях эксперимента, так и в реальной клинической практике установлено, что курсы терапии должны быть достаточно длительными, регулярно повторяемыми [9].
Следует подчеркнуть, что Карницетин хорошо переносится и может быть использован в комбинации с другими лекарственными препаратами. В экспериментальных и клинических условиях было показано, что применение Карницетина повышает поступление в ткань мозга галантамина – ингибитора ацетилхолинэстеразы, препарата, широко используемого для лечения пациентов с БА и некоторыми другими типами деменции [32].
Отмечено увеличение концентрации ацетилхолина – одного из ключевых нейротрансмиттеров реализации когнитивных функций преимущественно в лобной коре и гиппокампе, причем в количествах, достоверно превышающих соответствующие показатели в контрольной группе. Имеются данные и об участии Карницетина в синтезе ацетилхолина в головном мозге [23]. Многочисленные исследования показали повышение эффективности Карницетина при его назначении и с препаратами липоевой кислоты, некоторыми другими антиоксидантами. Дальнейшие исследования позволят определить оптимальные комбинации препаратов, суточные дозы и сроки лечения при ведении пациентов с когнитивными нарушениями.
Литература
Терапевтический потенциал ацетил-L-карнитина в лечении когнитивных и депрессивных расстройств у пациентов пожилого возраста
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Дан обзор литературы по оценке терапевтического потенциала ацетил-L-карнитина (АЛК) (Карницетина) в лечении когнитивных и депрессивных расстройств у пациентов пожилого возраста. АЛК представляет собой мозгоспецифичное производное L-карнитина, он является легкодоступным субстратом для запуска энергозависимых обменных процессов в митохондриях, поставляя ацетильную группу непосредственно в матрикс митохондрий для образования ацетилкофермента А без расходования аденозинтрифосфата (АТФ) и кислорода. За счет улучшения энергетического обеспечения нейронов в условиях сниженного потребления кислорода АЛК защищает нейроны при ишемической гипоксии. В ряде экспериментальных исследований было установлено также антиоксидантное действие АЛК. АЛК уменьшает образование свободных радикалов и способствует сохранению АТФ. Благодаря структурному сходству с ацетилхолином оказывает холиномиметическое действие, а также модулирует активность дофаминергической и серотонинергической систем. Препараты на основе L-карнитина и АЛК относятся к энерготропным средствам, способным восстанавливать нарушенный клеточный энергетический метаболизм. В данной статье описаны механизмы действия препарата, проведена оценка эффективности и безопасности его применения в геронтологической практике. Приведен анализ результатов преклинических и клинических исследований АЛК в мировой медицинской практике.
Ключевые слова: поздний возраст, деменция, когнитивные расстройства, болезнь Альцгеймера, депрессия, лечение, ацетил-L-карнитин, Карницетин.
Для цитирования: Гаврилова С.И. Терапевтический потенциал ацетил-L-карнитина в лечении когнитивных и депрессивных расстройств у пациентов пожилого возраста. РМЖ. 2018;12(I):54-60.
The therapeutic potential of acetyl-L-carnitine in the treatment of cognitive and depressive disorders in elderly patients
S.I. Gavrilova
Mental Health Research Center, Moscow
A literature review is given on the evaluation of the therapeutic potential of acetyl-L-carnitine (ALC) (Carnicetine) in the treatment of cognitive and depressive disorders in elderly patients. ALC is a brain-specific derivative of L-carnitine, it is an easily accessible substrate for triggering volatile metabolic processes in the mitochondries, supplying the acetyl group directly to the mitochondrial matrix to synthesize acetyl coenzyme A without consuming ATP and oxygen. By improving the energy supply of neurons in conditions of reduced oxygen consumption, ALC protects neurons from ischemic hypoxia. A number of experimental studies have also established the antioxidant effect of ALC. ALC reduces free radicals formation and promotes the preservation of ATP.
Due to structural similarity with acetylcholine, it has a cholinomimetic effect, and also modulates the activity of dopaminergic and serotonergic systems. Pharmaceutic preparations based on L-carnitine and ALC refer to energy-consuming agents that can restore the damaged cellular energy metabolism. This article describes the mechanisms of action of the drug, assessed the effectiveness and safety of its use in gerontological practice. Analysis of the results of preclinical and clinical studies of ALC in the world medical practice is given.
Key words: late age, dementia, cognitive disorders, Alzheimer’s disease, depression, treatment, acetyl-L-carnitine, Carnicetine.
For citation: Gavrilova S.I. The therapeutic potential of acetyl-L-carnitine in the treatment of cognitive and depressive disorders in elderly patients // RMJ. 2018. № 12(I). P. 54–60.
Представлен обзор литературы по оценке терапевтического потенциала ацетил-L-карнитина в лечении когнитивных и депрессивных расстройств у пациентов пожилого возраста.
Болезнь Альцгеймера (БА) признана ВОЗ приоритетной проблемой современного здравоохранения в связи с неуклонным ростом численности больных и особой тяжестью ее медико-социальных последствий. Успешно развивавшиеся в течение последней четверти века биологические исследования патогенетических механизмов БА, как и достижения нейрофармакологии, к сожалению, не привели ни к открытию этиотропной терапии этого разрушительного нейродегенеративного процесса, ни к внедрению в клиническую практику эффективных методов его лечения, способных остановить или существенно замедлить прогрессирование деменции. Зарегистрированные международными регуляторными органами препараты для лечения БА (ингибиторы холинэстеразы и мемантин) способны давать только ограниченный во времени, умеренный симптоматический эффект. Столь скромные результаты психофармакотерапии БА обусловлены не только трудностями в поиске новых терапевтических мишеней и новых таргетных лекарственных средств, но и тем обстоятельством, что болезнь, как правило, впервые диагностируют и соответственно впервые начинают лечить только в стадии синдрома деменции, свидетельствующего о далеко зашедшем нейродегенеративном процессе с необратимыми распространенными патологическими изменениями в различных корковых и подкорковых структурах головного мозга, а также истощении компенсаторных механизмов, направленных на защиту и восстановление мозга.
В настоящее время установлено [1], что развитию деменции, обусловленной БА, предшествует длительный (до 20 лет) период субклинического течения заболевания. По данным расширенных популяционных исследований [2], не менее 5% пожилых (60 лет и старше) страдают деменцией, вызванной БА, а еще 18% — обнаруживают признаки когнитивных pacстройств, не достигающих уровня деменции. По результатам эпидемиологических исследований [3], среднегодовая частота конверсии синдрома мягкого когнитивного снижения (mild cognitive impairment — MCI) в деменцию альцгеймеровского типа равна 10–12%, тогда как в пожилой популяции без когнитивных нарушений она не превышает 1–2%.
В связи с этим задачами первостепенной значимости стали диагностика БА на ее наиболее раннем (продромальном, или додементном) этапе и разработка методов болезнь-модифицирующей терапии, направленной на предупреждение или замедление перехода заболевания в стадию, клинически определяемую формированием синдрома деменции.
Последние годы ознаменовались существенным прогрессом в области ранней (додементной) диагностики БА, что привело к расширению ее диагностических границ. Исследовательская группа Национального института старения США и группа экспертов Альцгеймеровской ассоциации разработали новые критерии (NIA-AA) прижизненной диагностики БА на ее субклиническом этапе, клинически соответствующем синдрому MCI [4, 5]. Синдром MCI неоднороден как по клинической структуре, так и по вероятности прогрессирования до деменции. За 5 лет примерно только у 1/2 больных с синдромом MCI была диагностирована деменция, обусловленная БА. Как следствие, было признано необходимым, особенно в исследовательских целях, «идентифицировать» критерии додементной диагностики БА как с клинических, так и с биологических позиций.
В соответствии с критериями NIA-AA диагноз БА при отсутствии у пациента деменции альцгеймеровского типа может быть поставлен на основании двух следующих симптомов: присутствия амнестического типа синдрома MCI (aMCI) и биомаркеров, отражающих биологическую природу альцгеймеровской нейродегенерации. Диагностическими биомаркерами БА признаны ликворные маркеры (снижение содержания β-амилоида и увеличение уровня общего и фосфолированного τ-протеина) и доказательства накопления амилоида (по данным исследования RET с амилоидным лигандом) в церебральных структурах. Однако исследование таких биомаркеров требует использования либо инвазивных, нередко травматичных для пожилых больных диагностических методик (таких как спинномозговая пункция), либо высокотехнологичных, весьма дорогостоящих диагностических методов, таких как RET с амилоидными лигандами. Таким образом, поиск надежных и доступных в массовом масштабе диагностических маркеров по-прежнему остается задачей первостепенной значимости как для исследователей и врачей, так и для самих пациентов и их семей.
Как свидетельствует анализ публикаций последних двух десятилетий, многочисленные попытки разработки превентивной терапии БА до сих пор не увенчались успехом. В качестве возможных превентивных терапевтических подходов применялись разные виды терапевтического вмешательства, включающие как средства нового поколения, применяемые в настоящее время для лечения БА (в частности, донепезил и галантамин), так и давно известные препараты (Гинкго двулопастного листьев экстракт, нестероидные противовоспалительные средства, статины, токоферола ацетат, аскорбиновая кислота и т. п.), однако ни один из них не показал клинически значимого превентивного эффекта.
Поиск возможных подходов к разработке превентивных противодементных терапевтических стратегий остается, наряду с разработкой новых методов ранней диагностики (нетравматичных и недорогостоящих), одним из основных направлений научных исследований, выполняемых в последнее десятилетие в отделе гериатрической психиатрии НЦПЗ. Предметом особого внимания стали исследования, направленные на разработку превентивного нейропротективного и нейротрофического воздействия, которое может расцениваться как своего рода барьер на пути развития нейродегенеративного процесса, повышая выживаемость нейронов в патологических условиях (например, при аномальном амилоидогенезе, эксайтотоксичности, ишемии, гипоксии, накоплении свободных радикалов и др.).
Появились новые данные о роли митохондриальной дисфункции в развитии нейродегенерации альцгеймеровского типа. Как известно, нормальное функционирование ЦНС зависит от адекватного церебральным метаболическим процессам поступления энергетических субстратов и кислорода, а также целого ряда веществ, необходимых для протекания физиологических, анаболических и катаболических процессов. Головной мозг имеет огромные энергетические потребности. В частности, известно, что ткань головного мозга должна получать для нормального функционирования до 40% от общего потребления организмом кислорода. Именно она при отсутствии адекватного снабжения кислородом оказывается наиболее уязвимой из всех жизненно важных систем организма. Причем наибольшей чувствительностью к ишемии обладают нейроны гиппокампа, пирамидные клетки, полосатое тело и клетки Пуркинье, которые в условиях ишемии необратимо повреждаются уже через 4–6 мин. Поскольку процессы памяти и другие когнитивные функции обеспечиваются корково-подкорково-гиппокампальными структурами мозга, именно когнитивная деятельность наиболее сильно страдает из-за гипоксии, ишемии и оксидантного стресса. В недавно проведенных исследованиях было установлено, что нарушение функций митохондрий играет триггерную роль в разрушении механизма, обеспечивающего энергетический метаболизм нейронов, и в запуске апоптоза — процесса программируемой клеточной гибели. В связи с этим возможность существенно уменьшить митохондриальную дисфункцию представляется актуальной задачей в разработке методов превентивной терапии БА и других деменций позднего возраста.
L-карнитин (ЛК) — природное низкомолекулярное вещество, которое синтезируется в печени и почках человека и животных. Одна из важных функций ЛК — перенос жирных кислот из цитоплазмы в матрикс митохондрий для образования в процессе β-окисления энергии, которая необходима для функционирования всех клеток организма [6]. Внутри митохондрий жирные кислоты, подвергаясь β-окислению, образуют ацетилкофермент А, который служит субстратом для цикла трикарбоновых кислот Кребса и последующего синтеза аденозинтрифосфата (АТФ) в организме [7]. ЛК оказывает защитное действие при апоптозе, что обусловлено ингибированием синтеза церамидов и активностью каспаз. Нейропротективный эффект ЛК, установленный в серии экспериментальных исследований на животных [8], предположительно связан с предотвращением нарушения метаболических процессов, приводящих к энергетическому дефициту.
Из ЛК в мозговой ткани, печени и почках синтезируется ацетил-L-карнитин (АЛК). АЛК представляет собой мозгоспецифичное производное ЛК, он является легкодоступным субстратом для запуска энергозависимых обменных процессов в митохондриях, поставляя ацетильную группу непосредственно в матрикс митохондрий для образования ацетилкофермента А без расходования АТФ и кислорода. Метаболическое равновесие между АЛК и ЛК является основой ацетильной буферной системы организма. За счет улучшения энергетического обеспечения нейронов в условиях сниженного потребления кислорода АЛК защищает нейроны при ишемической гипоксии, последствия которой связаны с запуском каскада эксайтотоксических реакций с накоплением в синаптической щели глутамата, активирующего NMDA-рецепторы и вызывающего неконтролируемый вход кальция в нейроны и последующую их гибель [9, 10].
В ряде экспериментальных исследований [11—13] было установлено также антиоксидантное действие АЛК. Введение АЛК перед острой экспериментальной ишемией уменьшает образование свободных радикалов и способствует сохранению АТФ. Благодаря структурному сходству с ацетилхолином АЛК оказывает холиномиметическое действие, а также модулирует активность дофаминергической и серотонинергической систем.
Препараты на основе ЛК и АЛК относятся к так называемым энерготропным средствам, способным восстанавливать нарушенный клеточный энергетический метаболизм. В зарубежной медицине они нашли довольно широкое применение. Способность карнитина и ряда его производных обеспечивать митохондрии нейронов энергетическим субстратом послужила основанием для его назначения больным с острым ишемическим инсультом, нейродегенеративными заболеваниями и при ряде соматических заболеваний [14, 15].
Карницетин — отечественный препарат на основе АЛК. Он продемонстрировал в экспериментальных условиях выраженное нейропротективное и нейротрофическое действие. При его пероральном введении экспериментальным животным (на модели БА) были выявлены его антиамнестическая активность и способность воздействовать на обучение при отсутствии нежелательных эффектов седативного или миорелаксирующего характера. За счет улучшения энергетического обеспечения нейронов АЛК защищает их при ишемии, последствием которой является запуск каскада патологических эксайтотоксических реакций с выбросом в синаптическую щель возбуждающих аминокислот (глутамат и аспартат), активирующих NMDA-рецепторы и вызывающих неконтролируемый вход кальцийзависимых протеаз с последующей гибелью нейронов.
По данным Т.А. Ворониной и Р.У. Островской [16], Карницетин сопоставим по эффективности и безопасности с зарубежными препаратами на основе АЛК. По сравнению с карнитином АЛК обнаруживает выраженную нейропротективную и нейротрофическую активность, способствующую восстановительным процессам в структуре клетки, что доказано на различных экспериментальных моделях. В частности, было установлено моделирующее действие Карницетина и способность поддерживать нормальное функционирование глиальной системы [17]. АЛК стимулирует синтез ацетилхолина из холина, действуя как поставщик активированных ацетильных групп. При длительном применении АЛК увеличивает плотность NMDA-рецепторов в гиппокампе, коре и стриатуме и препятствует возрастзависимому уменьшению их плотности [18]. В серии экспериментальных исследований [19] было выявлено, что введение АЛК может замедлить патологические процессы, вызванные окислительной деструкцией митохондрий у старых крыс. На модели экспериментальной ишемии было показано [20], что последующее введение АЛК предохраняет структуры лобной коры от свободного радикального окисления и тем самым уменьшает выраженность мозгового повреждения.
Особую значимость с точки зрения разработки патогенетической терапии БА представляют данные R. Epis et al. [19], касающиеся влияния АЛК на метаболизм b-амилоида, которое было установлено на моделях клеток нейробластомы и на нейронах гиппокампа экспериментальных животных. Полученные авторами результаты дали основание предполагать, что антиамнестическая активность АЛК, подтвержденная и в клинических, и в экспериментальных исследованиях, может быть обусловлена не только увеличением продукции ацетилхолина, но и его специфическим метаболическим действием на аномальный метаболизм β-амилоида, который рассматривается как первичное звено в каскаде патогенетических событий при развитии альцгеймеровской нейродегенерации. АЛК способствует усилению физиологической β-секретазной активности и тем самым снижает вероятность превращения (с помощью β- и γ-секретаз) белка-предшественника амилоида в амилоидогенный метаболит, обладающий нейротоксическими свойствами.
Появляется все больше доказательств позитивного влияния АЛК на процессы нейрогенеза и дифференцировки стволовых клеток в гиппокампе [21, 22], что открывает новые возможности в применении АЛК при нейродегенеративных заболеваниях в качестве средства превентивной терапии.
Была выполнена серия клинических исследований [23–26] АЛК у больных с деменцией, включая БА, и при возрастзависимых (недементных) когнитивных расстройствах. Контролируемые клинические испытания, проводившиеся в Японии, США и ряде европейских стран у пациентов с БА или другой деменцией, доказали способность препаратов на основе АЛК улучшать память и другие когнитивные функции как у недементных пожилых людей, так и у пациентов с деменцией, обусловленной БА или церебрально-сосудистой патологией. Результаты зарубежных клинических исследований эффективности препаратов АЛК при БА оказались не вполне сопоставимыми (из-за методологической неоднородности), однако большинство исследователей отметили позитивный эффект АЛК в отношении когнитивных функций, сопоставимый с эффектом антихолинергических препаратов. Одно из исследований было посвящено изучению терапевтической эффективности комбинированной терапии ингибитором ацетилхолинэстеразы (донепезила или ривастигмина) в сочетании с АЛК у тех пациентов с БА, которые оказались резистентными к лечению этими препаратами. Добавление АЛК к терапии донепезилом или ривастигмином позволило повысить эффективность терапии с 38 до 50%.
Результаты метаанализа [26] данных 21 рандомизированного контролируемого клинического исследования у больных с синдромом MCI и начальной стадией деменции при БА показали достоверные преимущества АЛК по сравнению с плацебо. В метаанализ были включены данные 1204 пациентов (средний возраст 71,9±0,5 года), из них 591 больной получал АЛК, 631 — плацебо. Суточная доза АЛК варьировала от 1,5 до 3,0 г/сут. Отличалась и продолжительность лечения: от 3 до 12 мес. Поскольку набор когнитивных шкал в исследованиях различался, для анализа использовали специальный расчетный коэффициент, учитывавший изменение по всем шкалам, а также отдельно оценивали коэффициент, отражающий эффективность по шкале общего клинического впечатления (CGI) или по шкале CIBIC. Результаты проведенного анализа показали значимо более высокую эффективность АЛК по сравнению с плацебо как по данным психометрической оценки с помощью когнитивных шкал, так и по общей клинической оценке. При этом была установлена высокая степень корреляции между этими параметрами. Достоверные изменения по шкале CGI в большинстве исследований отмечались уже к концу 3-го мес. терапии, а суммарный показатель терапевтической эффективности по психометрическим шкалам достигал максимума через 6 мес. лечения АЛК. Во всех исследованиях была установлена хорошая переносимость АЛК, количество нежелательных эффектов на фоне терапии АЛК оказалось сопоставимым с группой плацебо.
Также в течение последних 6 лет в отделе гериатрической психиатрии НЦПЗ была проведена серия клинических исследований по применению Карницетина у пациентов с начальной стадией деменции, обусловленной БА или сосудистой деменцией, у пациентов с aMCI, а также у пожилых депрессивных больных с сопутствующими нерезко выраженными органическими церебральными нарушениями различного генеза.
В двойном слепом плацебо-контролируемом исследовании Карницетина у пожилых с мягкой деменцией, обусловленной БА или церебрально-сосудистой патологией, приняли участие 60 больных, соответствующих критериям включения и исключения, из которых были составлены 2 сопоставимые по численности группы [27]. Все больные получали закодированные препараты: в 1-й группе — Карницетин в дозировке от 2250 до 3000 мг/сут, во 2-й — плацебо. Демографическое и синдромально-диагностическое распределение больных в обеих группах не имело значимых различий. Исследование продолжалось 4 мес., из которых 1 мес. занимал скрининг, 3 мес. — курсовое лечение. Эффективность терапии оценивали по клиническим и психометрическим шкалам: MMSE, CGI, субтестам «инициация», «концептуализация» и «память» шкалы деменции Маттиса, тесту рисования часов. Кроме того, оценивалась активность в повседневной жизни (шкала IADL). Оценка проводилась перед началом и после окончания лечения.
Результаты исследования показали достоверно большую частоту наступления положительного эффекта (по шкале CGI) у больных, принимавших Карницетин, по сравнению с группой плацебо. Терапевтический эффект Карницетина подтвержден значимым улучшением когнитивных функций больных при их оценке по ряду шкал: MMSE, тест рисования часов, по одному из тестов шкалы деменции Маттиса, а также по шкале IADL. При этом терапевтический эффект в отношении общего клинического улучшения (шкала CGI) оказался достоверно выше у больных БА, чем у пациентов с сосудистой деменцией. Различия в терапевтическом эффекте Карницетина у пациентов с БА и сосудистой деменцией не зависели от исходной выраженности когнитивного дефицита.
С учетом спектра фармакологической активности Карницетина (способность нивелировать негативные воздействия патогенетических факторов, участвующих в развитии нейродегенерации, и усиливать компоненты внутренней системы защиты и восстановления мозга за счет свойственного ему нейротрофического, нейропротективного и антиапоптозного действия), а также в связи с доказанной безопасностью его длительного применения представлялась весьма перспективной попытка разработки стратегии и тактики применения препарата в рамках превентивной противодементной терапии, особенно пожилых из группы риска БА или другой нейродегенеративной деменции.
В целях поиска подхода к решению этой задачи было предпринято открытое сравнительное исследование дозозависимых эффектов Карницетина при лечении пациентов из групп риска БА, т. е. пожилых, состояние когнитивных функций которых соответствовало синдрому aMCI. В 3-месячном исследовании сравнивались две суточные дозы Карницетина: 1770 мг/сут (т. е. по 2 капсулы 3 р./сут) и 2360 мг/сут (по 2 капсулы 4 р./сут). По исходным когнитивным характеристикам между группами пациентов, получавших разные дозы препарата, не было значимых различий. Критериями включения были: возраст от 50 до 90 лет, соответствие критериям диагностики синдрома аMCI, оценка по шкале Хачинского менее 4 баллов и оценка по шкале Гамильтона менее 18 баллов.
Для оценки эффективности лечения применяли следующие шкалы и тесты: MMSE, батарею лобной дисфункции, тест рисования часов, Бостонский тест называния, тест запоминания 10 слов, звуковые и категориальные ассоциации шкалы деменции Маттиса. Для оценки общего клинического эффекта использовали шкалу CGI. Безопасность терапии определялась по показателям витальных функций и с помощью регистрации нежелательных явлений [28].
К середине курса лечения было отмечено значимое улучшение когнитивных функций по большинству применяемых тестов в обеих группах больных. К окончанию терапии в группе, получавшей Карницетин в дозе 1770 мг/сут, было установлено значимое улучшение по всем проводившимся оценочным тестам и шкалам, кроме батареи лобной дисфункции. В то же время у пациентов, применявших бóльшую дозу препарата (2360 мг/сут), наблюдалось значимое улучшение только по 3 из 7 шкал. Однако показатель терапевтического эффекта, определявшийся по разности между финальной и исходной оценкой, не имел значимых межгрупповых отличий. По общему клиническому впечатлению терапевтический эффект оценивался как выраженное улучшение в большинстве случаев вне зависимости от применяемых доз препарата. Субъективная оценка пациентами эффекта лечения сводилась к улучшению концентрации внимания, запоминания, сообразительности и настроения. За период терапии наблюдались нежелательные явления у 2 пациентов — появление изжоги. Один пациент принимал препарат до еды, другой — после предварительного растворения в воде. У обоих больных изжога и чувство дискомфорта прошли после изменения режима приема лекарства.
Проведенное исследование показало эффективность и безопасность Карницетина и целесообразность применения дозы 1770 мг/сут (6 капсул в 3 приема) для лечения когнитивных расстройств у пожилых из группы риска БА (пациенты с синдромом aMCI).
Полученные в ходе этого пилотного исследования результаты свидетельствуют о целесообразности проведения более масштабного специального проспективного плацебо-контролируемого клинического испытания Карницетина в дозе 1770 мг/сут (с пероральным приемом) в виде повторяющихся 2 раза в год 3-месячных курсов терапии. Основанием для такого заключения служат как фармакологические характеристики препарата и наличие полимодальных нейротропных свойств, так и его доказанная клиническая эффективность при лечении начальных стадий БА, сосудистой деменции и додементных когнитивных нарушений, а также удобство перорального способа введения и безопасность препарата.
Особый практический интерес вызвали сообщения, посвященные антидепрессивным эффектам АЛК, в частности данные о результатах его применения при так называемой «сенильной депрессии» [17]. Как было ранее доказано, депрессия сопровождается нейродегенеративными изменениями в зубчатой извилине гиппокампа, выраженность которых коррелирует с длительностью депрессии. Важнейшим компонентом действия современных антидепрессантов считают их влияние на нейропластичность за счет стимуляции выброса нейротрофинов. Установленные нейротрофические эффекты АЛК и наблюдавшееся в отдельных клинических исследованиях его тимолептическое действие стали основанием для проведения двойного слепого рандомизированного исследования [29] применения АЛК в сравнении с флуоксетином у пожилых. АЛК назначали в дозе от 1,5 до 3,0 г/сут, флуоксетин — 40 мг/сут. Результаты клинического исследования показали, что АЛК обладает антидепрессивным эффектом, сравнимым с действием флуоксетина. Более того, в группе АЛК он выявлялся уже через неделю приема, значительно опережая соответствующее действие флуоксетина. Преимуществом АЛК было также существенное улучшение когнитивной деятельности к окончанию терапии, отсутствовавшее в группе флуоксетина. По данным этого исследования, свидетельствовавшего об эффективности применения АЛК у пожилых пациентов с депрессией и возможной когнитивной дисфункцией, было высказано предположение о вероятности потенцирующего действия Карницетина на терапевтический эффект антидепрессантов, по крайней мере у больных пожилого возраста.
Для проверки указанной гипотезы в отделе гериатрической психиатрии НЦПЗ было предпринято открытое сравнительное исследование противодепрессивной монотерапии с использованием одного из современных антидепрессантов (венлафаксин, агомелатин или флувоксамин) и комбинированной терапии теми же препаратами в сочетании с Карницетином [30]. В исследовании участвовали 40 больных в возрасте от 60 до 79 лет с депрессией легкой или умеренной тяжести (по МКБ-10), распределенных в 2 равные по численности, демографическим и клиническим характеристикам группы. Пациенты обеих групп получали антидепрессивную терапию. В группе комбинированной терапии Карницетин принимали в дозе 1000 мг/сут (по 2 капсулы 2 р./сут). Длительность лечения составила 8 нед. в обеих группах. Эффективность терапии оценивали с помощью шкалы депрессии Гамильтона (HAM-D-17) и по шкале тревоги Гамильтона (НАМ-А). Уровень когнитивной активности оценивали по шкале MMSE. Обследование проводилось в течение терапевтического курса 4 раза (до начала лечения, на 14, 28, 56-е сутки лечения). Оценка переносимости и безопасности терапии проводилась на основании шкалы регистрации нежелательных эффектов лечения (SARS).
Результаты проведенного исследования показали, что включение Карницетина в суточной дозе 1000 мг в антидепрессивную терапию позволяет достигнуть более быстрого и полного терапевтического ответа: через 4 нед. лечения полная ремиссия была достигнута в группе комбинированной терапии в 30% случаев, тогда как в группе монотерапии — только в 15,8%. Достигнутый к окончанию 8-недельного лечения эффект оказался более выраженным в группе комбинированной терапии: полная ремиссия была достигнута у большинства (73,6%) больных, принимавших дополнительно Карницетин, и только у 26,3% пациентов, леченных только антидепрессантами. Преимущество комбинированной терапии (Карницетин + антидепрессант) подтверждается и динамикой тестовых оценок по шкалам депрессии и тревоги Гамильтона, а также по шкале общего клинического впечатления.
Динамика когнитивных показателей оказалась положительной в обеих группах, однако в группе комбинированной терапии (с включением Карницетина) достоверный прокогнитивный эффект был достигнут уже к 28 сут лечения, тогда как в группе монотерапии — только к окончанию курса терапии. Переносимость применявшейся терапии оказалась лучшей также в группе сочетанной терапии. Нежелательные эффекты легкой или средней степени тяжести отмечались чаще (недостоверно) в группе монотерапии. Однако серьезных нежелательных эффектов не наблюдалось ни в одной из групп.
Таким образом, проведенное исследование позволило прийти к заключению об ускоряющем влиянии Карницетина (в суточной дозе 1000 мг) на развитие антидепрессивного терапевтического ответа и рекомендовать сочетанную терапию с Карницетином для оптимизации антидепрессивной терапии у больных пожилого и старческого возраста.
Некоторые авторы [31] связывают антидепрессивный эффект АЛК с его способностью участвовать в регуляции метаботропных рецепторов глутамата в гиппокампе и префронтальной коре. Однако механизмы антидепрессивного действия препаратов на основе АЛК, в т. ч. Карницетина, по мнению авторов, требуют дальнейшего изучения.
Не так давно итальянские авторы опубликовали 2 метааналитических исследования, посвященных антидепрессивным эффектам АЛК. N. Veronese et al. [32] провели анализ литературных источников по всем имеющимся базам данных. Рассматривались все опубликованные результаты рандомизированных клинических исследований по применению АЛК или комбинированных исследований с включением этого препарата при лечении депрессий. В качестве контрольной группы рассматривались пациенты с депрессией, получавшие плацебо или остававшиеся без лечения. Проанализированные данные касались 9 рандомизированных исследований, включавших 231 пациента, принимавшего АЛК, и 216 больных, получавших плацебо или нелеченых. Общий вывод сводился к тому, что применение АЛК достоверно редуцирует симптомы депрессии по сравнению с плацебо (или при отсутствии терапии). В 3 исследованиях, сравнивавших эффекты АЛК и известных антидепрессантов (по 162 больных в каждой группе), было показано, что рассматриваемый препарат обнаруживает терапевтический эффект, аналогичный эффектам зарегистрированных антидепрессантов. При этом число нежелательных эффектов при лечении АЛК оказалось достоверно меньшим в сравнении с антидепрессантами. Указывается также на наибольшую эффективность АЛК при лечении пожилых с депрессией.
В последнем из опубликованных в 2017 г. обзоров [33] анализируются эффекты АЛК. Помимо роли препарата в улучшении энергетического метаболизма, авторы акцентировали внимание на современных исследованиях, в которых были установлены его антиоксидантные, нейромодуляторные и нейропротективные терапевтические свойства. Их результаты стали основанием для изучения терапевтических возможностей препарата при целом ряде неврологических расстройств, а также при лечении депрессивных состояний (табл. 1) [10, 34–49]. 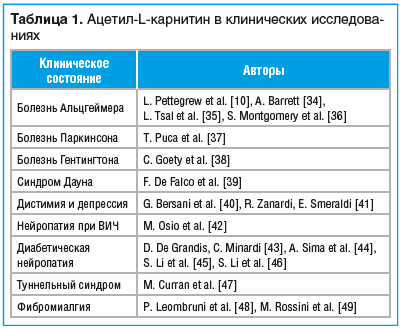
Сегодня АЛК зарегистрирован как препарат для лечения нейропатической боли. Недавние преклинические и клинические исследования, доказавшие его новые молекулярные, клеточные и энергетические механизмы действия, в сочетании с результатами клинических исследований дали основания авторам обзора рассматривать АЛК как лекарственное средство нового поколения антидепрессантов, сопоставимое по эффективности с рядом других средств той же группы, но имеющее более высокий профиль безопасности.
Широкий диапазон возможных механизмов действия был предложен для объяснения множественных эффектов препарата. К наиболее значимым из вновь установленных механизмов фармакологического действия следует отнести его нейротрофическое свойство, реализуемое через повышение активности фактора роста нерва (NGF) и повышение экспрессии NGF в рецепторах стриатума и гиппокампа. Этот механизм действия был доказан в ряде экспериментальных исследований на старых крысах [50–52]. Результаты экспериментов, проведенных авторами рассматриваемого обзора [53, 54], показывают, что АЛК регулирует активность NF-kВ-сигнального пути, тем самым повышая транскрипциональную активность белка. Этот эффект коррелирует со способностью препарата индуцировать экспрессию глутаматного рецептора 2-го типа (mGlu2), что может рассматриваться как потенциальный механизм, лежащий в основе широкого спектра его фармакологической активности от анальгетических до пронейрогенных и антидепрессивных компонентов действия.
В настоящее время антидепрессивный эффект АЛК еще не вполне ясен. Очевидно, что препарат имеет иной механизм действия, нежели классические антидепрессанты. По мнению авторов [54], механизм антидепрессивного действия АЛК может объясняться его высокой потенциальной нейрогенетической активностью, сопровождающейся влиянием на нейрональную дифференциацию прогениторных нейронов в гиппокампе. В этом отношении препарат обнаруживает сходство с классическими антидепрессантами, которые также повышают нейрогенез у экспериментальных животных при хроническом введении [55]. Однако вызванный АЛК нейрогенный эффект оказался более продолжительным, чем у классических антидепрессантов, и продолжался более 2 нед. после прекращения введения препарата, тогда как после окончания введения трициклического антидепрессанта он исчезал немедленно.
Другое объяснение антидепрессивного эффекта АЛК было предложено Т. Lau et al. [56], которые предположили, что препарат может действовать как антидепрессант через повышение уровня глиального нейротрофического фактора артемин.
Кроме того, показано [57], что АЛК повышает уровень норадреналина и серотонина в гиппокампе, которые являются позитивными модуляторами нейрогенеза у взрослых животных.
И наконец, авторы [56] допускают возможность того, что антидепрессивный эффект АЛК реализуется через повышение энергетического синаптического механизма. В экспериментальных исследованиях выявлено, что не только гиппокамп, но и префронтальная кора, и нейроны миндалины являются теми структурами, в которых препарат улучшает структурную пластичность.
Таким образом, АЛК, представляющий собой препарат с широким спектром действия, по-видимому, превосходит классические моноаминергические антидепрессанты, что выражается в быстроте наступления терапевтического эффекта при лучшей его переносимости. Установленные мультимодальные механизмы действия АЛК открывают новые возможности его применения не только в терапии когнитивных расстройств при нейродегенеративных заболеваниях, но и в лечении хронической боли при миалгических синдромах (в т. ч. широ-
ко распространенных у пожилых больных фибромиалгий), а также депрессивных расстройств. Необходимо подчеркнуть, что этот препарат может найти широкое применение в гериатрии как эффективное и безопасное средство лечения широко распространенных в пожилой популяции когнитивных, депрессивных и болевых синдромов, которые в значительной части случаев выступают в рамках одного клинического состояния, независимо от его этиологии.



